Page 52 - Vol.31
P. 52
Tech
Notes
技術專文
表 1、先進製程含鈷廢水水質分析 表 3、電路板各製程廢水 / 廢液處理回收措施
含鈷廢水 鈷濃度 其餘金屬濃度 氧化物濃度 製程 桶槽別 化學品 製程廢棄物 一般槽浴維護與回收方案
ECP廢硫酸鈷電鍍液 2300ppm <1ppm NA 抗焊綠漆 顯像 碳酸鈉 清洗廢水通常不含金屬;製程 以產品處理表面積分析方式,替代作業時間
溶液含阻溶劑 分析方式,進行槽浴管理。
清洗晶圓之含鈷廢水 65ppm <1ppm NA
熱風整平 酸洗、 鹽酸、微蝕劑 清洗廢水含銅金屬。製程溶液 暫無適當方式
噴錫 微蝕 含1 g/L銅
助焊劑 L-麩胺酸鹽酸、 暫無適當方式
表 2、金屬表面處理相關廢水重金屬減量方案 聚烴基乙二醇等
錫浸鍍 錫鉛 錫鉛渣、清洗水、微量溶解 錫鉛渣通常委外回收處理
減量方案 建議方法 應用情形 應用限制 鉛、鉛屑、含鉛鹽清洗廢水
鍍鎳金 剝錫鉛 氫氟化銨、硝酸、甲基磺酸 含鉛清洗廢水 可利用擴散透析回收系統
一般減廢 改善操作程序、減少帶出量、減少 所有傳統電鍍作業均適用、應納 舊式設施可能因限於既定製程與有限空間,無法
措施 清洗水用量、減少空氣污染逸散 入標準作業程序、所需要的設備 進行改變 微蝕 過硫酸鈉硫酸/雙氧水 含銅清洗廢水、含銅廢浴液含 清洗廢水以離子交換方式回收;廢浴液以冷
成本極低 1-2 g/L銅 卻結晶回收硫酸銅
更新製程 熱噴塗裝:火燒、電弧、電漿 主要用於修復作業,但逐漸應用 作業技術仍持續發展,商業應用限於特殊需求 鍍鎳 硫酸鎳、氨基磺酸鎳或專利混 浴液含鎳可達15 g/L;清洗廢 清洗廢水可應用電解沉積回收銅金屬,然後
真空蒸鍍法:離子披覆、離子佈 於配合作業、主要用於高價的高 限於不計成本的零件加入,例如航太、軍品、電 合浴液 水含鎳 用離子交換回收鎳。過濾、活性碳處理與電
植、濺鍍、雷射表面重熔化學氣相 科技產品、能改善產品品質與耐 子產品等 析法(假鍍)均為常用的方式。
磊晶法 用性 需要更好的程序控制、員工訓練、自動設備等
鍍金 金氰化鉀 浴液含氰化物。 廢水以離子交換回收金。清洗廢水與廢浴液
替代製程 產品改變 所有傳統電鍍作業均適用、專屬 代工廠較無原料改用控制權、產品改變要先評估 以電解沉積回收金,並陽極氧化分解氰化
原料改用無毒種類:氰化物、鎘、 的作業線可探討產品改變 客戶接受度、產品規格迫使放棄製程改變 物。
鉻
製程溶液 傳統維護方式 傳統維護方式所有傳統電鍍作業 革新維護方式需求大幅更改製程設計、操作方式
維護 革新維護方式:微過濾、離子交 均適用 與化學成份
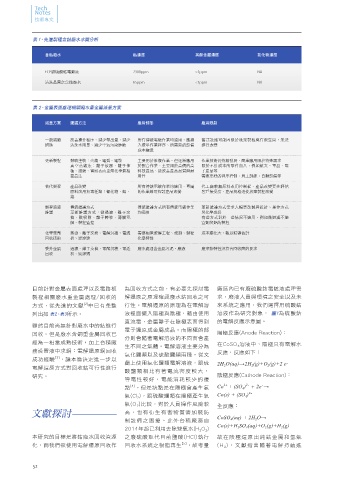
換、酸吸附、離子轉移、薄膜電 有些方式對於一些情況不適用,例如微過濾不適 圖1、鈷於電解槽內陰陽極反應示意圖 圖2、電解金屬選擇還原性
解、製程監控 宜銅與鋁的製程
化學藥劑 蒸發、離子交換、電解沉積、電透 需要相當瞭解工程、規劃、製程 成本變化大,難以精確估計 DC POWER SOURCE
回收技術 析、逆滲透 化學特性 -ve +ve Other Metals
Zinc
委外金屬 過濾、離子交換、電解沉積、電透 廢水處理含金屬污泥、廢液 廢棄物特性須符合回收商的要求 Electron Flow Electron Flow
回收 析、逆滲透 To Cathode e - e - From Anode Iron
.
Cobalt 弱於Hydrogen
H 2O
Cathode Reaction Anode Reaction Nickel
Co 2+ 基準 Tin hydrogen
e-
2+
Co + 2 → Co H 2O → 2H + O 2 + 2 e-
+
e-
+
目前針對金屬表面處理以及電路板 為回收方式之前,有必要先探討電 廠區內已有廢硫酸鈷電鍍液處理需 (2H + 2 → H 2) H 2O Copper
,
製程相關廢水重金屬處理/回收的 解還原之原理確認廢水鈷回收之可 求,廢液人員與環境之安全以及未 Co 2+ Silver
(We don’t want) Platinum
[2]
方式,從先進的文獻 中已有彙整 行性。電解還原的原理為在電解溶 來系統之應用,我們選擇用硫酸鈷
Cathode Anode Gold
列出如 表2、表3所示。 液裡面擺入陽極與陰極,藉由使用 溶液作為研究對象, 圖1為硫酸鈷
直流電,金屬離子在陰極表面得到 的電解反應示意圖。
雖然目前尚無針對廢水中的鈷進行
電子還原成金屬成品。而陽極的部
回收。但是廢水含銅重金屬回收已 陽極反應(Anode Reaction):
分則會隨著電解溶液的不同而會產
經為一相當成熟技術,加上台積廠 在CoSO 4 溶液中,陽極只有電解水
生不同之氣體。電解溶液主要分為 =m'÷(I•t•k)×100%
務設置液中求銅:電解還原銅回收 反應,反應如下: 行,原先持續在陰極生成鈷金屬, 鈷金屬。
氯化鹽類以及硫酸鹽類兩種。從文
[3]
成功經驗 ,讓本篇決定進一步以 會開始產生氫氣(H 2 )而鈷金屬生成 但隨著電解進行,電解溶液pH值 η 為電流效率
獻上使用氯化鹽類電解溶液,跟硫 2H 2 O(aq)→2H 2 (g)+O 2 (g)+2 e -
電解還原方式對回收鈷可行性進行 趨緩,探究其原因為鈷和氫在陰極 會持續下降。原因氫離子濃度不 m' 實際產出重量(g)
酸鹽類相比有著電流密度較大, 電極之還原順序有關 。依據 圖2電
[4]
研究。 陰極反應(Cathode Reaction): 斷累積增加,故氫離子更容易生 m 按照法拉第定 律獲得理論的產
導電性較好,電能消耗較少的優 解金屬選擇還原性可以看到:鈷在 + 出物重量(g)
2+
[4]
點 。但是缺點是在陽極會產生氯 Co + (SO 4 ) 2 - + 2e - → 陰極的還原順序中跟氫基準相比較 在陰極生成氫氣:2H (aq)+2e - → I 電流強度(A)
4
氣(Cl 2 ),跟硫酸鹽類在陽極產生氧 Co(s) + (SO 4 ) 2- 電位較小(-0.28V)。理論上氫離子 H 2 (g) 。但氫氣並非我們所想要的
產品,此現象造成了電解還原時電 t 通電時間(hr)
氣(O 2 )比較,對於人員操作風險較 (H )應先在陰極會得到電子析出氫
+
全反應: 流效率降低。在電解還原裡,電流 k 為電化學當量(g/(A-hr))
文獻探討 高,也有衍生有害物質需加裝防 CoSO 4 (aq) + 2H 2 O→ 氣。但是氫離子在金屬材料上析出
制設備之困擾。此外台積廠務自 時有不同之過電位,故實際氫析出 不會完全用到生成金屬上,故實際 鈷理論析出量為1.100克每安培小
Co(s)+H 2 SO 4 (aq)+O 2 (g)+H 2 (g) 上生成的金屬量與理論上生成金屬
2014年起已利用去除雙氧水(H 2 O 2 ) 電位比理論氫平衡電極電位更低。 時(g/(A-hr))而其差異主要是因為有
量之比就是電流效率。公式如下:
本研究的目標是將鈷廢水回收資源 之廢硫酸取代目前鹽酸(HCl)執行 故在陰極還原出純鈷金屬和氫氣 故在陰極上鈷的電位值較氫離子 電流損耗:如陰極生成氫氣,電解
[5]
化,而我們欲使用電解還原回收作 回收水系統之樹脂再生 ,故考量 (H 2 ),文獻指出隨著電解持續進 高,能先在陰極上獲取電子而變成 η=m'÷m×100% 液之電阻值,pH值的影響,溫度的
52 300mm FABS FACILITY JOURNAL SEPTEMBER 2018 53