Page 86 - 52
P. 86
TSMC/ Facility Published
2.2.2 硫酸稀釋溫升機制
❶水合反應 (hydration reaction)
硫酸為二元酸強酸,具高腐蝕性、脫水性、吸水性與氧化性,室溫下穩定,但純硫酸熔點高 (283.4K/10.3℃ ),
為方便運輸製成常見之 98% 硫酸。硫酸與水之所以高度放熱主要因為水合反應,過程中釋放氫離子,由酸度
解離係數 (acid dissociation constant) 得知硫酸與水之強親和性。
+ + −
H 2 SO 4 H 2 O → H 3 O + HSO 4 pKa1 = 2.8
2−
+
−
HSO 4 + H 2 O → H 3 O + SO 4 pKa2 = − 1.92
❷溫升放熱焓值 (enthalpy) 變化
−
+
將硫酸與水混合後,硫酸迅速解離 H 2 SO 4 (l) → H (aq)+HSO 4 (aq),以標準莫爾生成熱計算過程中焓值變化,
可大致分為兩種計算方式 [06] :
▪無限制量稀釋 : 通常適用於一次性方式稀釋 (batch dilution process)
+ −
H 2 SO 4 (l)、H (aq)、HSO 4 (aq) 分別為 −813.989kJ/mol rxn 、0kJ/mol rxn 、−855.75kJ/mol rxn
▪固定量稀釋 : 通常適用於緩慢添加方式計算 (continuous dilution system)
假設熱卡計測量為理想環境,即熱量
無任何被吸收及散失,透過比熱容公
式計算得知最後稀釋升溫溫度,即可
概略得知溫升結果 :
q = − q rxn = mS∆T = mS(T final −T initial )
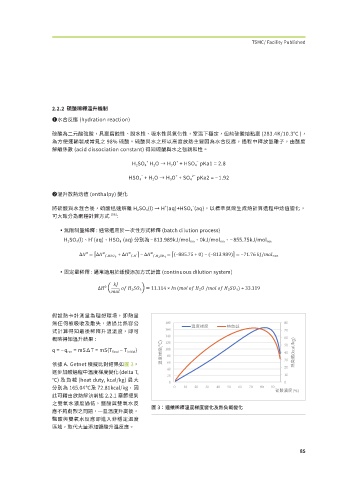
依據 A. Getnet 模擬比對結果如圖3,
逐步加酸過程中溫度梯度變化(delta T,
℃) 及 負 載 (heat duty, kcal/kg) 最 大
分別為 165.04℃及 72.81kcal/kg,因
此可藉由放熱解決前述 2.2.1 章節提到
之雙氧水濃度過低,鹽酸與雙氧水反
圖 3:連續稀釋溫度梯度變化及熱負載變化
應不夠劇烈之問題,一旦溫度升高後,
鹽酸與雙氧水反應即進入非穩定溫度
區域,取代大量添加鹽酸升溫反應。
��