摘要

廢氣處理設備大突破 - 紫外光技術應用於氧化亞氮減量
Keywords / Green House Gas,Nitrous Oxide,Thermal Type Local Scrubber (LSC),UV Photolysis
2015年12月聯合國COP21巴黎協定,通過限制全球升溫不超過攝氏2度的目標,各國政府紛紛提出國家自定減碳計畫,面對日益嚴格之溫室氣體減量管制趨勢,為達到廠區自我要求改善目標,本文以目前台積電僅次於PFCs第二大量直接排放的溫室氣體氧化亞氮N2O(佔整體排放約9%)為改善重點。已知N2O來源之CVD與DIFF製程廢氣所使用的電熱式尾氣處理設備(以下簡稱Local Scrubber),其破壞與去除效率(Destruction and Removal Efficiency, DRE)僅有5~15%,因此本研究主要評估目前半導體產業廢氣處理技術,包括燃燒、電漿破壞法及觸媒熱解法對於N2O處理之優缺點,並研究紫外光裂解(UV Photolysis)技術結合廠區現有local scrubber應用於N2O減量改善,可提供未來長期系統改善與建置新方法之參考。
前言
聯合國氣候變化綱要公約(United Nations Framework Convention on Climate Change, UNFCCC)第二十一次締約國大會(COP21)於2015年12月12日通過巴黎協定(Paris Agreement),各國提出國家自定貢獻(National Determined Contributions, NDC)將從事相關減排具體措施,以達成控制本世紀末全球升溫不超過攝氏2度的目標,並以攝氏1.5度為努力方向。臺灣雖然不是 UNFCCC締約國,但也積極為減緩地球暖化貢獻心力,在去年10月提交COP21的NDC,除了溫室氣體減量及管理法(2015.7.1公告生效)明訂長期目標2050年全國二氧化碳總排放量減少50%,增訂中期減碳目標2030減碳20%(皆以2005年為基準年)。台積電2014年總碳排放量約為5.9 MtCO2e(二氧化碳當量),總碳排貢獻主要為「間接排放」之電力(70%),而其餘30%為「直接排放」之溫室氣體,其中N2O為僅次於PFCs第二大量直接排放的溫室氣體,約占9%,目前公司針對PFCs之減量措施已有成效,但N2O始終並未經適當處理而排放。
本研究探討之溫室氣體為氧化亞氮(N2O),其受京都議定書(Kyoto Protocol)所管制,可於大氣中存在114年,根據IPCC第四次評估報告,其全球暖化潛勢(Global Warming Potential, GWP)為二氧化碳的298倍(以100年計)[2]。此外,亦參與許多光化學反應,具破壞大氣臭氧層潛勢,在一份發表於Science科學期刊的研究報告中,美國國家海洋暨大氣管理局(NOAA)的科學家指稱N2O已將成為新的主要破壞臭氧層物質(Ozone-Depleting Substance, ODS)[3]。在「蒙特婁破壞臭氧層物質管制議定書」(Montreal Protocol on Substances that Deplete the Ozone Layer,以下簡稱蒙特婁議定書)的規範下,20年來國際上的氟氯碳化物(CFC)已經逐年被削減;相較之下,氧化亞氮將會成為大氣中主要的ODS。N2O在對流層時相當穩定,但飄至平流層時會被分解為氮氧化物,產生破壞臭氧的連鎖反應。目前N2O未被蒙特婁議定書訂定限制標準,其破壞破壞臭氧層潛值(ODP)為0.017(即CFC-11的1.7%)。因此,及早對於N2O執行使用管制、削減處理以達排放減量,將會成為對全球氣候變遷與臭氧保護的重要課題。
N2O 排放來源分析
全球與國內N2O排放分析
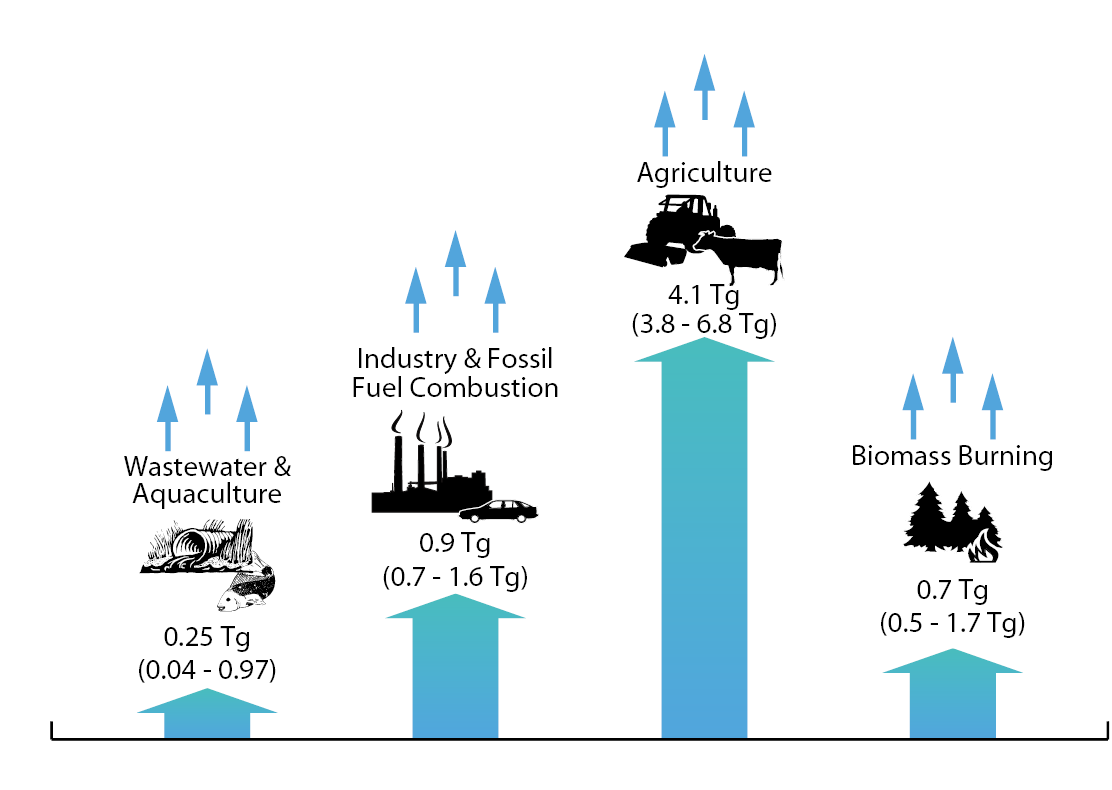
氧化亞氮(N2O)俗稱「笑氣」,在大氣中自然存在微量的N2O。由於地球上生命的存在和生物氮化合物的循環,導致副產物N2O的產生並排放至地球大氣中。根據2013年聯合國環境規劃署(UNEP)最新報告《Drawing Down N2O to Protect Climate and the Ozone Layer》顯示,目前全球人為N2O排放來源與貢獻量估計,如 圖1,農業活動是人為N2O排放最大的來源,包括氮肥、畜禽排泄與作物秸秆等,排放貢獻為66%。此外,其他主要的N2O排放源包括工業和化石燃料燃燒(15%)、生物質燃燒(12%)以及廢水與水產養殖(4%)[4]。
圖1、目前全球人為N2O 排放來源與貢獻量估計[4]
而台灣N2O排放來源為工業製程及產品使用部門、農業部門、與能源部門,廢棄物部門也有少量排放,如 表1。農業部門氧化亞氮排放係以農耕土壤排放為主,排放來源包括農地化學肥料使用、動物排泄物、固氮作物、農作物殘體等。而工業製程及產品使用部門近年氧化亞氮排放逐年增加,是以化學工業及電子工業為主,排放來源包括己內醯胺、乙二醛、乙醛酸生產、硝酸生產、積體電路或半導體及TFT平面顯示器等[1]。
|
年 |
1990 |
1991 |
1992 |
1993 |
1994 |
1995 |
1996 |
1997 |
1998 |
1999 |
2000 |
2001 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
部門別 |
||||||||||||
|
1. 能源部門 |
537 |
578 |
652 |
703 |
739 |
772 |
816 |
861 |
912 |
961 |
1,047 |
1,070 |
|
1.A.1. 能源工業 |
138 |
158 |
183 |
207 |
221 |
239 |
267 |
302 |
332 |
364 |
432 |
453 |
|
1.A.2. 製造業與營造業 |
91 |
94 |
100 |
99 |
101 |
101 |
105 |
107 |
111 |
113 |
125 |
127 |
|
1.A.3. 運輸 |
291 |
309 |
353 |
382 |
402 |
418 |
428 |
438 |
456 |
469 |
475 |
475 |
|
1.A.4. 其他 |
17 |
17 |
15 |
14 |
15 |
14 |
16 |
14 |
14 |
14 |
15 |
16 |
|
2. 工業製程及產品使用部門 |
166 |
352 |
325 |
301 |
318 |
345 |
186 |
374 |
383 |
312 |
625 |
800 |
|
3. 農業部門 |
1,880 |
1,908 |
1,857 |
1,881 |
1,881 |
1,874 |
1,915 |
1,723 |
1,624 |
1,599 |
1,813 |
1,778 |
|
3.B 農林漁牧 |
48 |
50 |
52 |
54 |
59 |
61 |
67 |
70 |
71 |
72 |
73 |
71 |
|
3.D 工業製程部門 |
1,820 |
1,850 |
1,791 |
1,821 |
1,815 |
1,810 |
1,846 |
1,651 |
1,551 |
1,524 |
1,736 |
1,702 |
|
3.F 土地利用變化及林業部門 |
12 |
8 |
15 |
7 |
6 |
2 |
2 |
2 |
2 |
2 |
4 |
5 |
|
5. 廢棄物部門 |
296 |
285 |
298 |
311 |
313 |
334 |
337 |
337 |
321 |
329 |
331 |
340 |
|
總計 |
2,878 |
3,122 |
3,133 |
3,196 |
3,251 |
3,326 |
3,254 |
3,294 |
3,240 |
3,201 |
3,816 |
3,988 |
|
年 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
|
部門別 |
||||||||||||
|
1. 能源部門 |
1,124 |
1,175 |
1,215 |
1,251 |
1,283 |
1,294 |
1,238 |
1,200 |
1,237 |
1,253 |
1,232 |
1,227 |
|
1.A.1. 能源工業 |
475 |
529 |
549 |
576 |
604 |
624 |
604 |
573 |
581 |
583 |
578 |
569 |
|
1.A.2. 製造業與營造業 |
137 |
133 |
135 |
132 |
137 |
149 |
139 |
131 |
144 |
151 |
144 |
148 |
|
1.A.3. 運輸 |
496 |
495 |
513 |
527 |
527 |
508 |
481 |
483 |
500 |
507 |
498 |
498 |
|
1.A.4. 其他 |
16 |
17 |
18 |
17 |
15 |
13 |
14 |
13 |
12 |
12 |
12 |
12 |
|
2. 工業製程及產品使用部門 |
833 |
923 |
926 |
1,047 |
1,428 |
1,542 |
1,301 |
1,466 |
1,834 |
1,762 |
1,674 |
1,539 |
|
3. 農業部門 |
1,793 |
1,672 |
1,796 |
1,672 |
1,704 |
1,666 |
1,590 |
1,625 |
1,609 |
1,546 |
1,571 |
1,489 |
|
3.B 農林漁牧 |
70 |
71 |
69 |
71 |
72 |
71 |
72 |
71 |
70 |
71 |
71 |
71 |
|
3.D 工業製程部門 |
1,718 |
1,598 |
1,724 |
1,599 |
1,630 |
1,594 |
1,517 |
1,553 |
1,536 |
1,474 |
1,499 |
1,417 |
|
3.F 土地利用變化及林業部門 |
4 |
3 |
2 |
2 |
3 |
1 |
2 |
2 |
2 |
2 |
2 |
1 |
|
5. 廢棄物部門 |
348 |
353 |
343 |
350 |
351 |
360 |
328 |
327 |
337 |
344 |
339 |
339 |
|
總計 |
4,097 |
4,122 |
4,279 |
4,320 |
4,766 |
4,863 |
4,457 |
4,618 |
5,017 |
4,905 |
4,816 |
4,594 |
|
( 單位:千公噸二氧化碳當量 ) |
||||||||||||
臺灣1990年N2O排放量為2,878ktCO2e(單位:千公噸二氧化碳當量),2013年臺灣N2O排放量約為 4,594ktCO2e,其中工業製程及產品使用部門排放約占33.5%、農業部門排放約占32.41%、能源部門排放約占26.71%、廢棄物部門排放約占7.38%[1],詳如 表1。就N2O總排放量而言,1990至2013年排放量增加59.64%,平均成長率1.69%,相同期間下,以農耕土壤排放量減少最多達 22.14%,平均成長率為-1.15%,與行政院農業委員會實施休耕及推廣合理化施肥有關。而工業製程及產品使用部門明顯地有逐年增加的趨勢。
國內半導體廠N2O排放分析
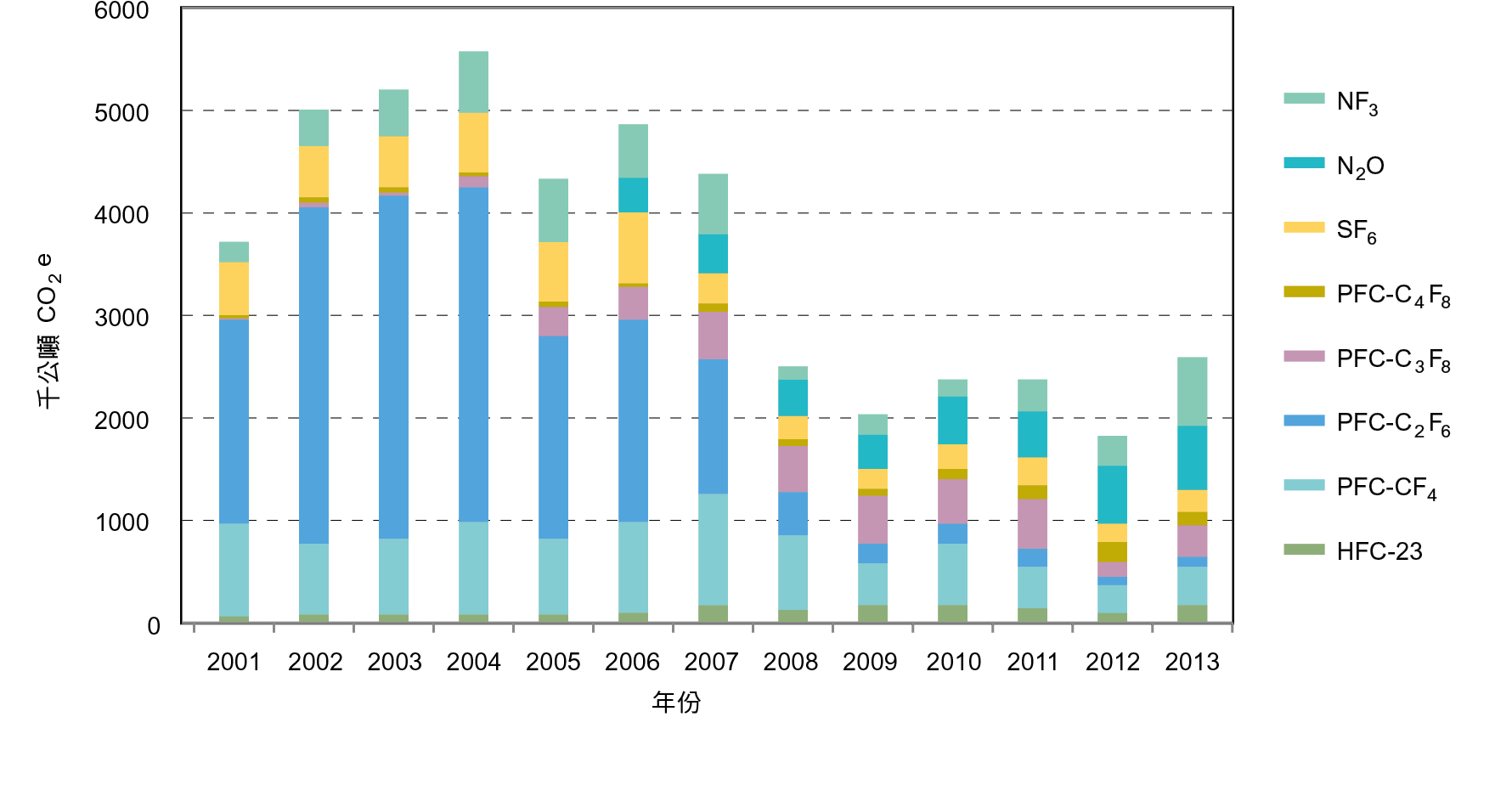
2000年前因積體電路或半導體產業廠商家數少,氫氟碳化物、全氟碳化物、六氟化硫使用量低,亦無進口之關稅號列,故未進行統計。2001至2013年積體電路或半導體主要排放溫室氣體種類為PFCs,由於台灣半導體產業協會(Taiwan Semiconductor Industry Association, TSIA)配合政府推動自願減量,導入安裝Local Scrubber,亦同時以量測程序進行製程改善,以減少PFCs的使用排放,使PFCs排放量逐年降低,占積體電路或半導體排放量約34.7%,NF3占26.5%、N2O占24.1%、SF6占8.2%、HFC占6.5%[1],如 表2及 圖2所示。
|
年 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
部門別 |
|||||||||||||
|
HFC-23 |
51 |
59 |
59 |
59 |
73 |
91 |
171 |
118 |
168 |
164 |
134 |
86 |
169 |
|
PFC-CF4 |
913 |
704 |
752 |
917 |
733 |
875 |
1,084 |
723 |
398 |
597 |
408 |
266 |
361 |
|
PFC-C2F6 |
1,976 |
3,289 |
3,348 |
3,263 |
1,980 |
1,974 |
1,308 |
417 |
189 |
198 |
177 |
84 |
102 |
|
PFC-C3F8 |
22 |
37 |
37 |
110 |
293 |
321 |
464 |
460 |
476 |
441 |
483 |
141 |
301 |
|
PFC-C4F8 |
22 |
48 |
37 |
37 |
37 |
41 |
77 |
57 |
63 |
86 |
134 |
201 |
135 |
|
SF6 |
524 |
499 |
513 |
587 |
587 |
695 |
292 |
229 |
198 |
239 |
261 |
181 |
213 |
|
N2O |
NE |
NE |
NE |
NE |
NE |
342 |
389 |
360 |
333 |
482 |
466 |
558 |
626 |
|
NF3 |
202 |
359 |
455 |
587 |
623 |
512 |
590 |
136 |
198 |
156 |
306 |
295 |
687 |
|
總計 |
3,711 |
4,994 |
5,199 |
5,559 |
4,237 |
4,850 |
4,375 |
2,500 |
2,298 |
2,363 |
2,502 |
1,812 |
2,595 |
|
備註:NE,代表未調查估計該分類項目。早期積體電路或半導體未大量生產,故無追溯調查1990至2000年排放量。 ( 單位:千公噸二氧化碳當量 ) |
|||||||||||||
圖2、臺灣2001 至2013 年積體電路或半導體溫室氣體排放量趨勢[1]
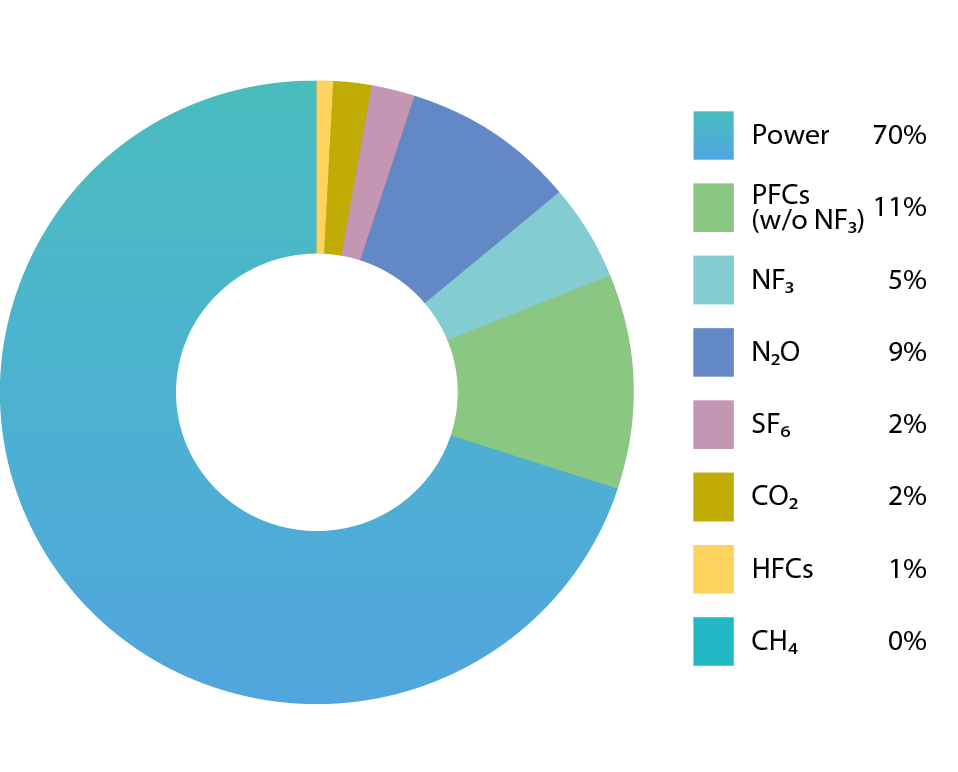
台積電在2014年總碳排放量約為5.9MtCO2e,占全台灣之2.2%。其中碳排貢獻主要為「間接排放」之電力來源(70%),台灣的發電廠大部分採用火力發電,也就是藉燃燒化石燃料產生電力,同時也生成二氧化碳,據研究指出,每產生1度電所消耗的化石燃料約釋放0.67公斤之二氧化碳,因此只要用電便會造成溫室氣體的排放。而其餘30%之總碳排放來自「直接排放」之溫室氣體,包括PFCs(11%)、N2O(9%)、NF3(5%)、CO2(2%)、SF6(2%)、HFCs(1%)等溫室氣體,其貢獻量如 圖3及 表3所示。其中N2O占全台積電總碳排放之8.7%(約9%),主要來源為化學氣相沉積(CVD)製程與擴散(DIFF)製程使用大量N2O,未經適當處理而排放。目前N2O尚無政府間氣候變遷專門委員會(Intergovernmental Panel on Climate Change, IPCC)公告之製程耗用率以及管末處理削減率,故迄今TSIA採用保守原則使用量100%全部排放申報,亦即目前半導體產業並未針對N2O設置相關處理設施進行削減,因此,N2O使用量或排放量逐年增加所衍生出溫室效應以及對臭氧層破壞之問題將日趨嚴重,需積極採取相關防治措施。目前廠內尚未使用最適當之-Local Scrubber,且聯合國與我國環保署尚無估算削減率的方法學來評估既有-Local Scrubber對N2O的削減狀況。若廠內安裝適當之N2O削減設備或研究開發其他技術,使其達到削減率大於95%,便可減少全公司約9%之碳排放量。
圖3、2014 年TSMC 溫室氣體碳排放比例
|
FAB |
CH4 |
HFCs |
CO2 |
SF6 |
N2O |
NF3 |
PFCs |
Power |
Sum |
|---|---|---|---|---|---|---|---|---|---|
|
TSMC All |
1041 |
81785 |
82608 |
106335 |
488019 |
276659 |
614884 |
3931883 |
5583214.4 |
|
0.02% |
1.46% |
1.48% |
1.90% |
8.74% |
4.96% |
11.01% |
70.42% |
100% |
|
|
300mm |
747 |
39565 |
66339 |
14637 |
352893 |
118022 |
199052 |
3105149 |
3896405.8 |
|
0.02% |
1.02% |
1.70% |
0.38% |
9.06% |
3.03% |
5.11% |
79.69% |
100% |
|
|
200mm |
293 |
42219 |
16270 |
91698 |
135126 |
158637 |
415832 |
826733.3 |
1686808.6 |
|
0.02% |
2.50% |
0.96% |
5.44% |
8.01% |
9.40% |
24.65% |
49.01% |
100% |
|
|
( 單位:公噸二氧化碳當量 ) |
|||||||||
半導體業N2O處理技術與難題
現有N2O處理技術
燃燒破壞技術Burn Type Local Scrubber
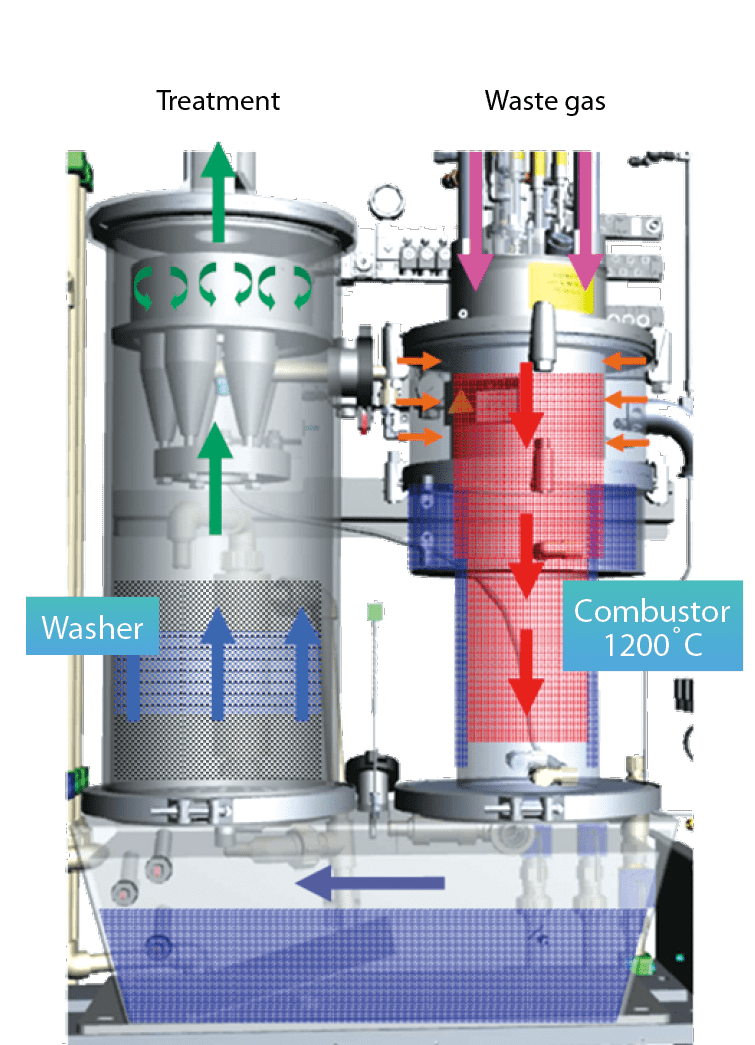
利用瓦斯燃燒產生高熱,使氣體經過高溫處理(1200 ℃)後裂解,再經由水洗將污染物水解/離子化後進入液相而去除,如 圖4所示。可處理的氣體包括:氧化亞氮(N2O)、氫氟碳化物(HFCs)、全氟碳化物(PFCs)、六氟化硫(SF6)。該設備在使用端(Point-of-Use)藉由瓦斯與氧氣操作參數之調整,運用成熟的燃燒/水洗技術來分解N2O,可達到高效率(大於90%)之N2O廢氣處理,解決許多精進製程在提高生產效率的同時相對帶來的挑戰。目前燃燒式Local Scrubber在半導體產業中大約占總量的15~20%,主要應用於非無塵室ETC process與大量使用氫氣機台如EPI process。雖然使用瓦斯燃燒可有效處理N2O等溫室氣體,但是會衍生氮氧化物(NOx)問題,NOx破壞自然生態的平衡,為環境保護者及立法者首要管制的廢氣。除此之外,瓦斯燃燒相對於其他機型有較高的安全風險疑慮,因此燃燒式Local Scrubber在無塵室環境是不被使用的。
圖4、Burn type local scrubber 構造流程圖
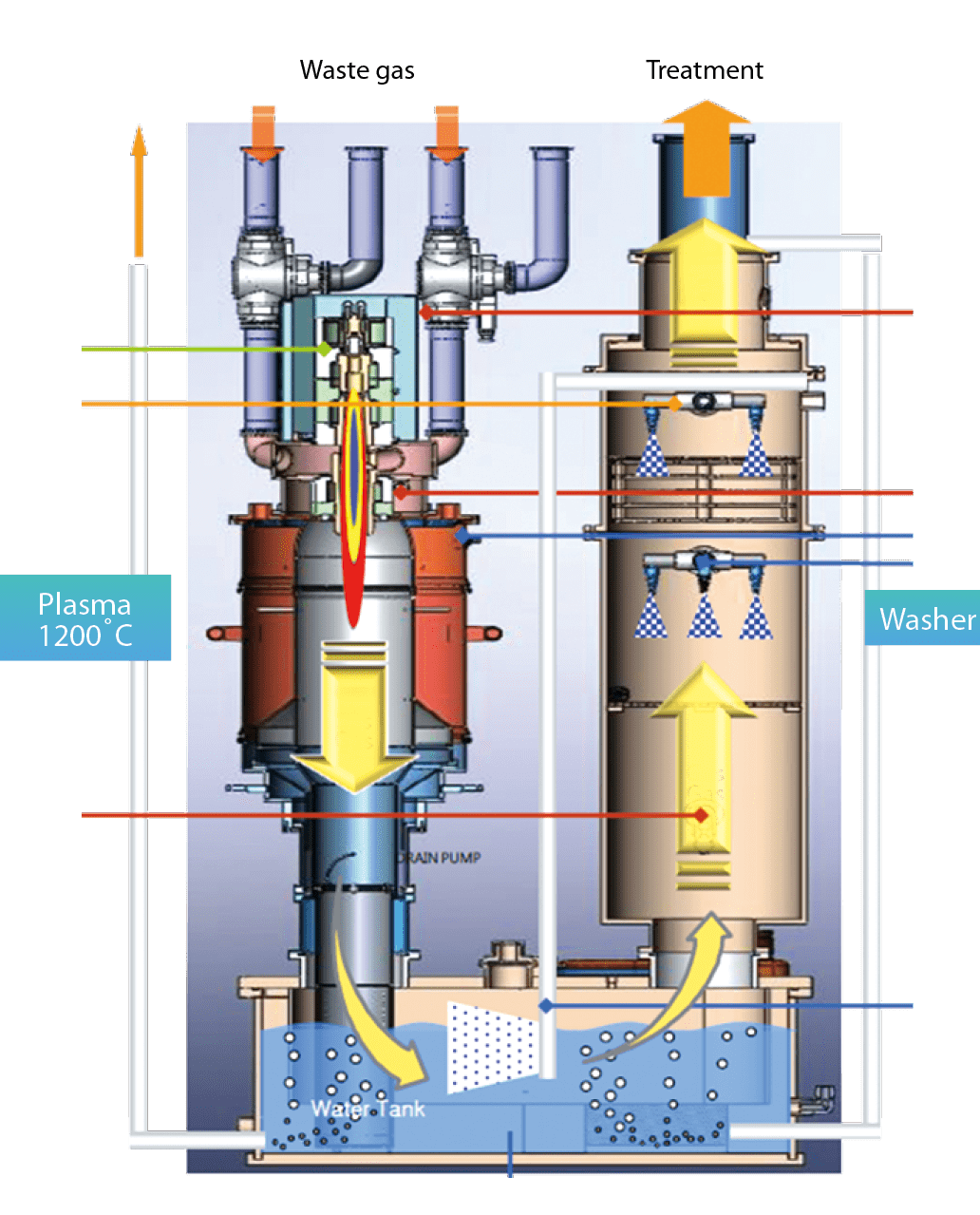
電漿破壞技術 Plasma Type Local Scrubber
利用高電能使氣體離子化轉變為電漿產生高溫(1200℃)解離較難處理之有害性氣體,再經由水洗段去除,如 圖5所示,基本上處理的方式與氣體種類與燃燒式類似。在最新的研究領域中,大部分的Local Scrubber較傾向此方向之研究,主要原因為其能源消耗是利用電力的方式,較為環保且安全性高,此種機型在半導體產業中約占總量的5~8%,主要應用於無塵室ETC process。雖然使用高溫電漿可有效處理N2O達到90%以上之削減率,但其處理氣量遠低於燃燒式,以同樣大小之Local Scrubber而言,燃燒式處理量可達電漿式的兩倍到三倍,因此需考量到機台以外的附屬設備footprint皆要最大化利用之預算問題。
圖5、Plasma type local scrubber 構造流程圖
觸媒熱裂解技術 Catalytic Pyrolysis Technology
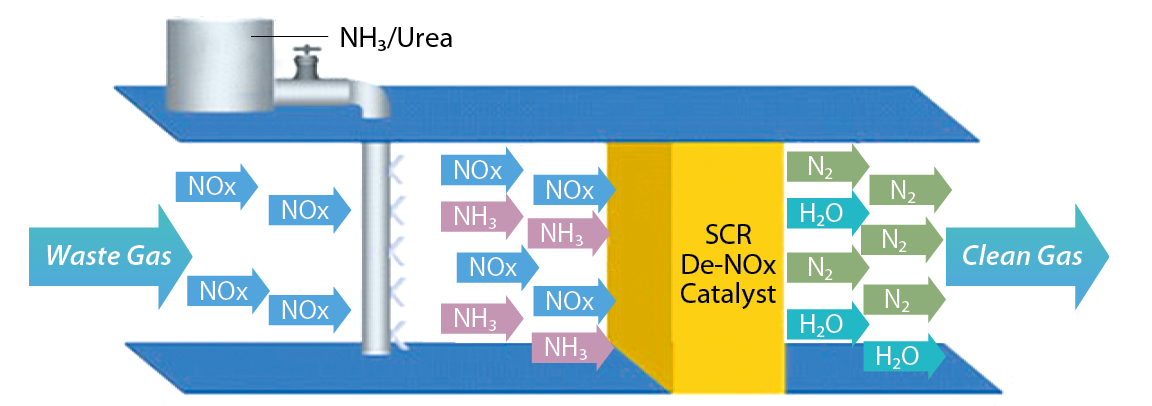
熱裂解技術可在較低的操作溫度(650℃)下,使用觸媒降低反應活化能,以降低裂解反應所需溫度。因為溫度低,相對節省不少操作成本。另外,「選擇性觸媒還原法」(Selective Catalytic Recovery,簡稱SCR),亦是公認能夠高效率處理氮氧化物(NOx)的有效方法,大部份都是利用「液態氨」(Liquefied Ammonia, NH3)或是「尿素水溶液」[Aqueous Urea Solution, CO(NH2)2],作為SCR處理NOx的還原劑,廢氣溫度控制在250~400℃,混入氨基還原劑後,經過觸媒將有毒的NOx還原為無害的N2與H2O,如 圖6所示。該技術脫硝效率高,NOx的脫硝率可達到90%以上,但是液氨屬法規管制之有害物質,具有安全風險及使用限制;而尿素的儲存、運輸及供氨系統不需要特殊的安全防護,是較安全的脫硝還原劑,但若廢氣溫度低於205℃、尿素水溶液反應時,所產生的氨氣會與廢氣中的硫產生反應成為「尿鹽」(Ammonia Salt),如硫酸銨(NH4HSO4),此容易造成觸媒內部通道嚴重堵塞並且難以清理,進而大幅縮短觸媒的使用壽命。雖然觸媒在反應過程中不會被消耗,但有可能會與副產物結合而改變其化學性質,進而失去活性,此現象稱之為「毒化」。
圖6、選擇性觸媒還原法(SCR)脫硝反應示意圖
以上三種技術對於N2O處理之應用評估均有各自的優缺點,其整理如 表4所示。
|
N2O可行處理技術 |
技術優點 |
技術缺點 |
|---|---|---|
|
燃燒破壞法 |
1. N2O破壞率>90% 2. 技術成熟度高 3. 結構簡單易維護 4. 處理量較大 5. 熱機時間短 |
1. 須提供大量H2/CH4等燃料氣 體增加成本 2. H2 /CH4易燃爆炸性氣體,增加工安風險,不適用於無塵室 3. 產生NOx副產物 |
|
電漿破壞法 |
1. N2O破壞率>90% 2. 技術成熟度高 3. 高溫高能量密度 4. 熱機時間短 5. 工安風險小,適用於無塵室 |
1. 火炬陰極壽命短,須定期更換 2. 對電極冷卻要求高 3. 火炬電源成本相對較高 4. 處理量較小 5. 產生NOx副產物 |
|
觸媒熱裂解法 |
1. N2O破壞率>90% 2. 技術成熟度高 3. 操作溫度低,省能源 4. 結構簡單易維護 |
1. 觸媒堵塞、老化、毒化問題 2. 觸媒更換、回收處理成本高 3. 無法處理矽甲烷(SiH4) |
目前廠區現況與難題
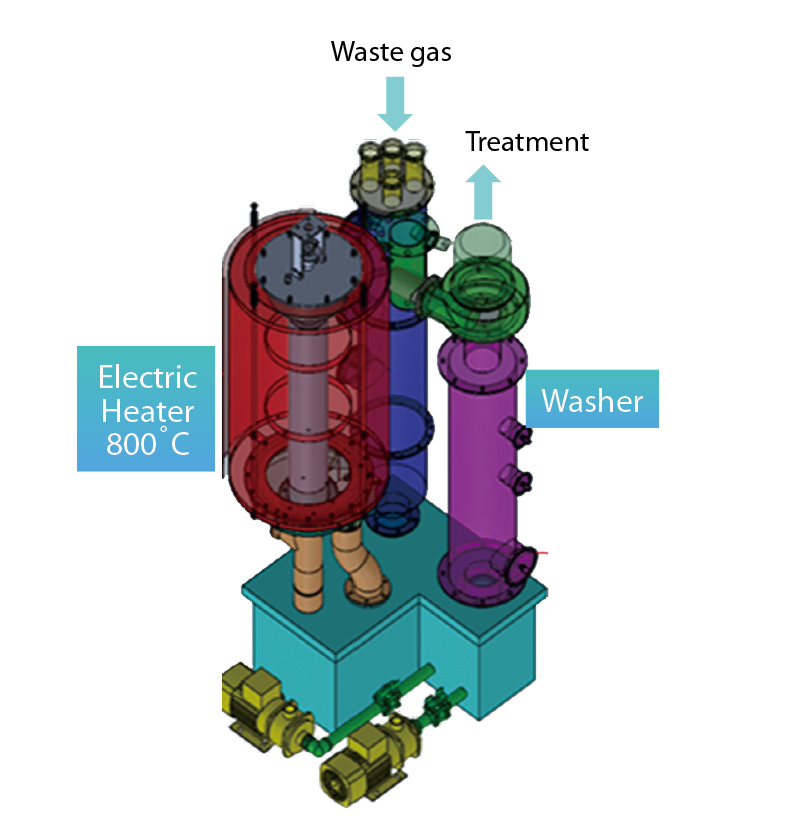
廠內N2O主要來源之CVD與DIFF製程廢氣皆使用「電熱式尾氣處理設備」(Thermal type local scrubber),其主要是利用電能轉換成熱能,使氣體經過高溫(800℃)處理後裂解與氧化,再經由水洗將污染物抓下,其構造流程圖如 圖7所示。可有效處理的有害性氣體包括:矽甲烷(SiH4)、四氟化矽(SiF4)、磷化氫(PH3)、三氟化氮(NF3)、氫氟酸(HF),此機型在半導體應用最廣也為最大宗,占50~60%,主要原因為機台費用遠低於燃燒式與電漿式,且保養維護與運轉費用較低。此外,上述之氣體並不需要大於1000℃即可裂解處理,但此溫度限制卻無法提供足夠的熱能將N2O裂解。
圖7、電熱式尾氣處理設備構造流程圖
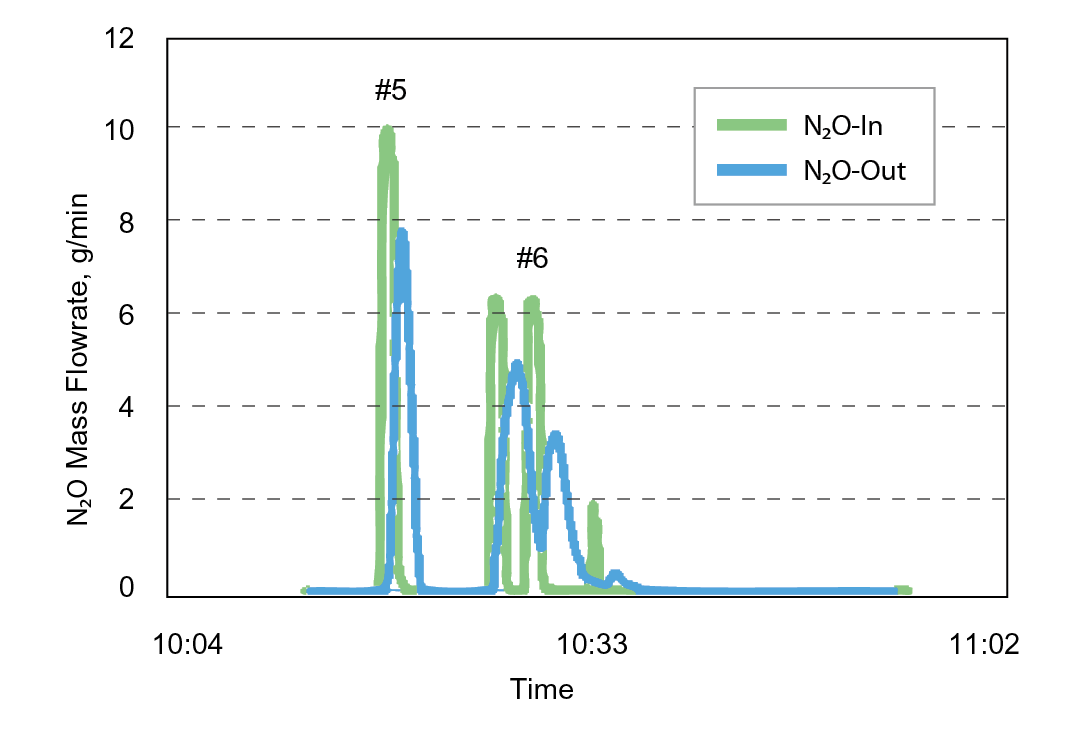
根據工業技術研究院檢測資料顯示,無論是純氣N2O或是製程N2O廢氣,當電熱式local scrubber chamber溫度約為800℃時,其破壞與去除效率(Destruction and Removal Efficiency, DRE)僅小於5%,如 表5及 圖8所示。
|
Test |
Chamber type |
LSC Chamber Temp., °C |
N2O DRE |
|---|---|---|---|
|
#3 |
Pure Gas: N2O 12000sccm*3 chambers |
808 |
<5% |
|
#5 |
Running Process*3 chambers |
797 |
<5% |
|
#6 |
Running Process*1 chamber |
797 |
<5% |
圖8、電熱式尾氣處理設備 (800℃ ) N2O 質量流率測試圖表(引用工研院合作檢測數據)
目前可行的解決方案評估如下:
更換廢氣處理機型
CVD與DIFF使用及排放N2O的製程local scrubber由電熱水洗式改為燃燒式或電漿式,可達到預期之處理效率。但是,更換機型需要耗費大量人力與經費,其費用估算如 表6所示,依據300mm Fab電熱式local scrubber數量將近1000台(不含備機),若全數更換為可處理N2O之燃燒式與電漿式Local Scrubber,其台數比約為燃燒式(非無塵室):電漿式(無塵室)=5:1,可預估將目前電熱式改為其他機型Local Scrubber費用高達約40億,運轉成本每年將增加約5億多。此外,經高溫燃燒產生氮氧化物(NOx)副產物之衍生問題也需列入考量。
|
Item |
300mm Fab:1000 sets |
Thermal type |
Burn type |
Plasma type |
|---|---|---|---|---|
|
LSC type changing cost |
Total cost (hookup/ Initial) |
0 |
3,166,666 |
650,000 |
|
Changing cost increase : 3,816,666 (KNTD) |
||||
|
LSC running cost |
Total cost (Utility consumption/Maintenance) |
408,000 |
835,833 |
91,000 |
|
Running cost increase : 518,833 (KNTD/Y) |
||||
改善現有Local Scrubber
可調整操作參數,提升現有電熱式Local Scrubber之效能,如:將電熱器升溫以提供更多熱能裂解N2O。根據工研院實廠檢測報告顯示,如 表7,當電熱式Local Scrubber之電熱器溫度增加至980℃(限制小於1000℃)時,其DRE可從5%提升至50%左右,雖有改善但效率仍不佳。
|
Inlet, ppm |
Outlet, ppm |
DRE*, % |
||||
|---|---|---|---|---|---|---|
|
Ave. |
Max. |
Ave. |
Max. |
L.D.L |
||
|
NF3 |
177 |
1271 |
N.D. |
- |
0.32 |
>99.9% |
|
SiH4 |
859 |
9131 |
N.D. |
- |
0.77 |
>99.9% |
|
SiH4 |
378 |
13184 |
N.D. |
- |
0.13 |
>99.9% |
|
N2O |
23186 |
104920 |
2937.4 |
9316.9 |
- |
49.8% |
|
HF |
446 |
9262 |
N.D. |
- |
8.13 |
>99.6% |
|
* Heater Temperature操作在980℃ |
||||||
研發適當之N2O削減設備或其他技術
前文提到,將電熱式結合觸媒之熱裂解法可降低反應活化能,亦即不需要太高的溫度即可加強裂解反應,但其觸媒堵塞、老化、毒化問題較不適用於半導體產業。因此,如何找到適當的N2O削減技術是解決問題之重要方向,由上述處理技術可知,裂解N2O需要足夠的能量來源,除了提供熱能或降低能階之外,「光能」也可作為另一種能量來源,而紫外光波長短、能量高,後續將探討紫外光應用於N2O處理之可行性。
紫外光反應原理與技術應用可行性
大氣的光化學(Photochemistry)反應機制
氧氣(O2)與紫外光之反應機制
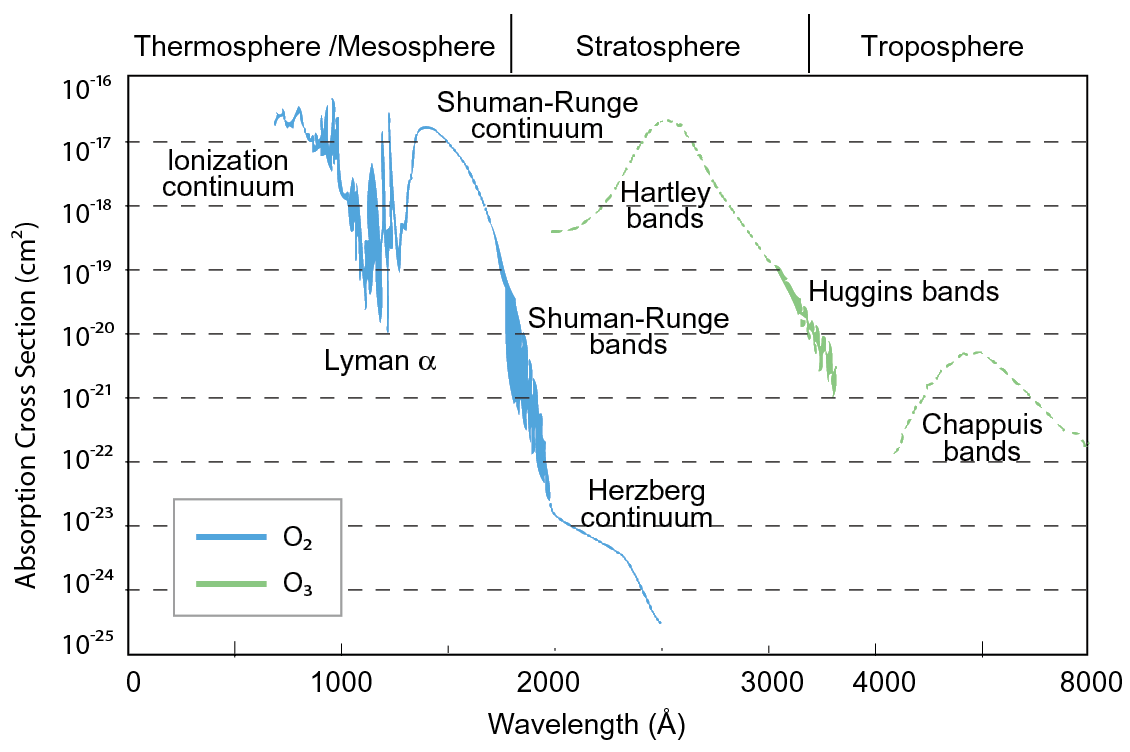
氧氣吸收太陽輻射主要在波長小於240 nm真空紫外光(vacuum ultra-violet)區域的吸收,氧氣於平流層(stratosphere)中透過短波UV輻射解離為激發態氧原子(O)[9],並形成平流層主要的臭氧。
O2 + hv → O + O (λ<240nm)
O(3P) + O2 → O3
而通過紫外光(λ=200-310nm)的照射可以分解臭氧產生更多的激發態氧原子,進而合成氧氣。
O3 + hv → O2 + O (λ=200-310 nm)
O + O3 → O2 +O2
大氣中,UV光的吸收主要由氧氣與臭氧進行光化學反應,其吸收截面光譜範圍如 圖9所示。
圖9、O2 與O3 之吸收截面光譜範圍
氧化亞氮(N2O)與紫外光之反應機制
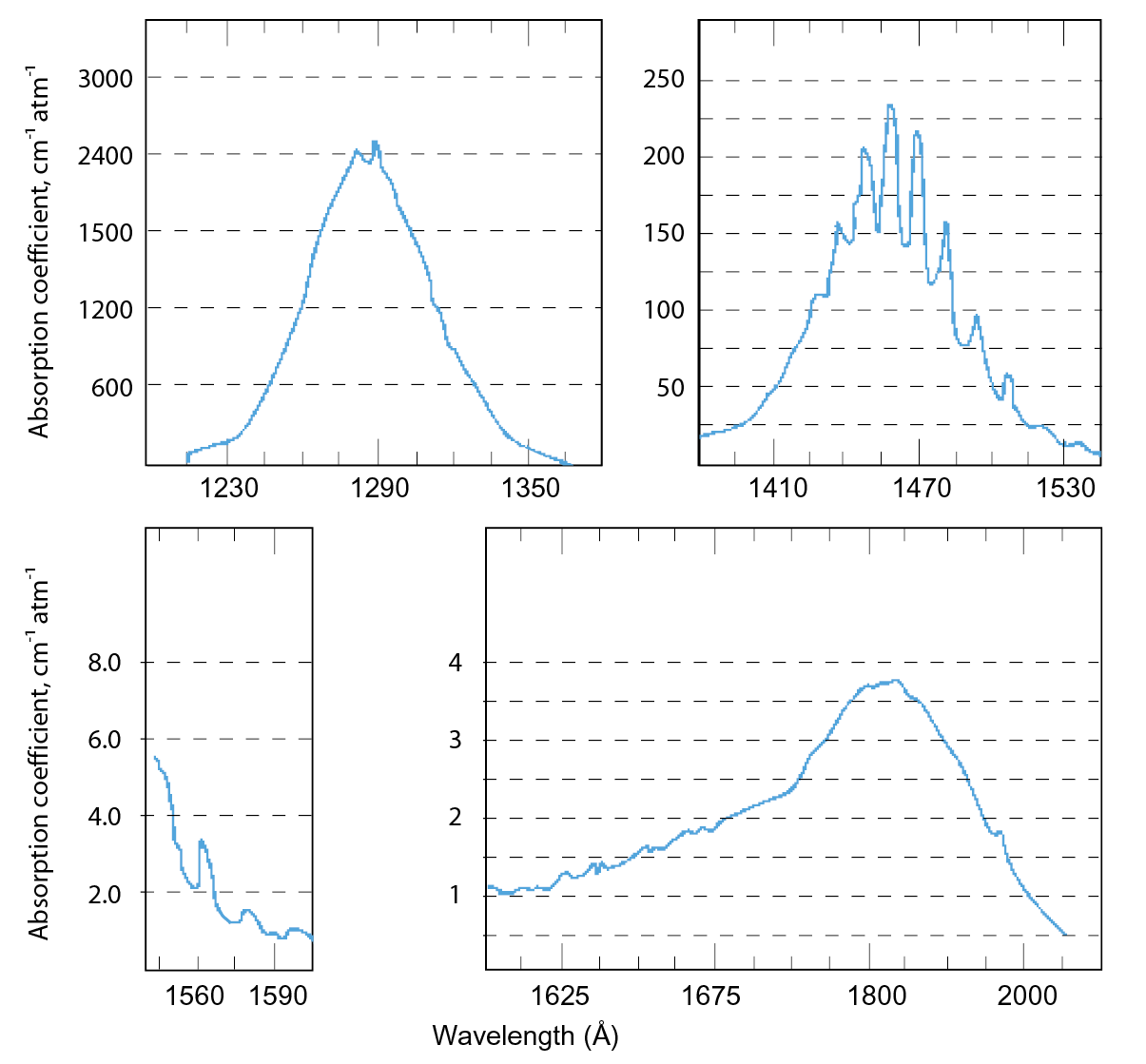
氧化亞氮在大氣層中的存在壽命為120年左右,在對流層中是化學惰性,但在平溫層中可以利用紫外光輻射的光解作用將90%之氧化亞氮分解,而剩下的10%與激發態原子氧O(1D)反應而消耗掉,生成氮氣(N2)、氧氣(O2)與一氧化氮(NO),其反應式子如下[10]。氧化亞氮吸收紫外光主要在波長小於215 nm,其各波段之吸收截面光譜如 圖10所示。
N2O + hv → N2 + O (90%) (λ=180-215 nm)
N2O + O → N2 + O2 (6%)
N2O + O → 2NO (4%)
圖10、N2O 之吸收截面光譜範圍[11]
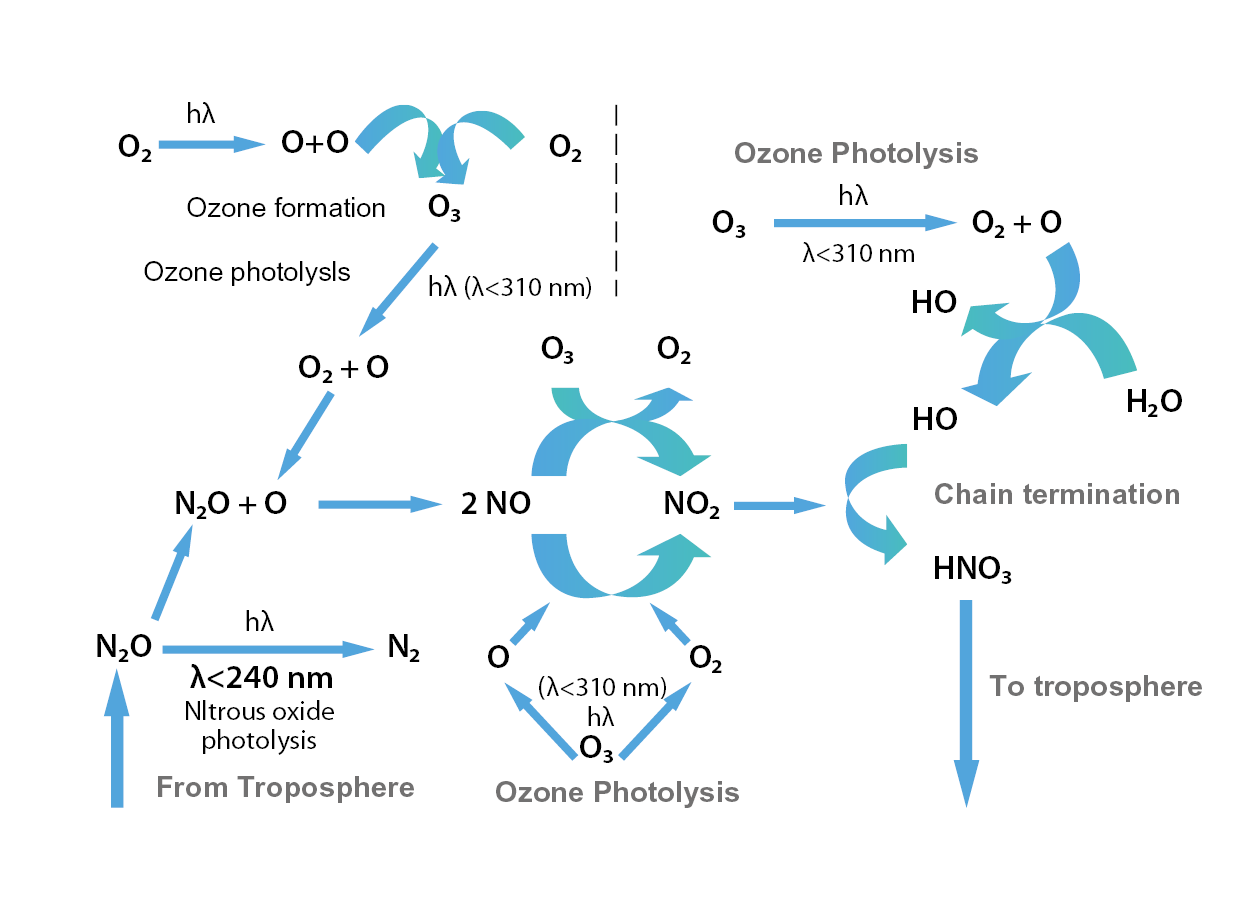
因此,若一環境中存在氮氧化物(NOX)與氧氣、臭氧,透過吸收紫外光能量而產生一連串光化學反應,其分解催化循環示意如 圖11[12],NOX最終與氫氧自由基(HO)反應形成硝酸(HNO3)。
圖11、NOX-Ozone decomposition catalytic cycle[12]
紫外光之直接光解與間接光解
紫外光為具有高能量之光波,經常應用於催化反應、滅菌、監測污染化合物等。此外紫外光之高能量也具有降解有機污染物的能力,在高強度的紫外光照射下,也能達到一定的脫色效果[5]。根據光化學理論Grotthus-Draper與Einstein-Stark兩大定律,第一定律(Grotthus-Draper Law),在光照射下光子被反應物吸收後才能促使化學變化發生;第二定律(Einstein-Stark Law),當分子吸收光子或量子(Quantum)後,產生電子轉移現象而使分子「活化」。電子由低能階被激發而躍升至高能接軌道,若電子軌道恰於化學鍵上且入射光能量充足時,則可將分子化學鍵斷裂,並產生自由基反應(Free Radical Reactions)。光解(Photolysis)為污染物光照後進行轉變的過程,通常可分為直接光解及間接光解兩大類[6]。
直接光解(Direct photolysis)
物質吸收光能轉為激發態後,物質本身繼續進行化學反應而分解。一般分為兩個階段:
- 第一階段,物質吸收光能後成為受激發態,受激發態物質進行初級光化反應(如式一);
- 第二階段,初級光化過程的產物再進行次級光化反應,此步驟無須吸收光線便可以進行分解作用(如式二)。
初級反應中因分子吸收光子,增加本身的振動與轉動能成為激發態,進而引發後續反應程序。
A + hv → A* ......式一
A* → D1 + D2 ......式二
A:反應分子;hv:光能
A*:受基態分子
D1, D2:分解產物,為原子或自由基
依據光吸收的基本原理,光子的能量計算公式如下[7]:
E=hv=hc/λ
其中:
E:光子能量(J)
h:普朗克Planck constant(6.626×10-34J·s)
v:頻率(s-1)
c:光速(3×108m·s-1)
λ:光子波長(m)
1電子伏特(eV)=1.6 x10-19(J)
間接光解(Indirect photolysis)
透過光感物質(photosensitizers)例如:溶解性有機物質(DOMs)、碳酸氫根離子(HCO3-)、硝酸根離子(NO3-)及O2等吸收光能後產生的高反應性物質(e.g., HO·, O·, O3, HO2·, CO3·, NO3·等),這些物質稱為過渡態的光氧化物質(transient photo-oxidants),與標的化合物接觸而進行降解之化學反應的過程[8],即為間接光解。系統中存在之光感物質吸收光能達到激發態後,誘發系統中另一物質產生化學反應,此間接光化學反應可以下列簡單反應式表示:
B + hv → B* ......式三
B* + A → B + A* ......式四
A* → D1 +D2 ......式五
B:光感物質
hv:光能
A:被誘發物質(標的化合物)
D1, D2:分解產物,為原子或自由基
欲利用直接光解的機制來降解有機物,其選用條件的限制如下:(a)光源波長必須針對不同目標污染物需打斷之鍵能選定不同的光源波長,才能提供足夠能量讓物質吸收後進行直接光解, 表8為常見的化學平均鍵能表,其中鍵能是指氣相分子在25℃斷開1莫耳該鍵所需之能量。因此在光源上的選擇須選用人工光源達到特定波長;(b)直接光解在反應過程中,需要較長的反應時間。而間接光解在實際應用上,是利用催化劑(如光感物質、氧化劑等)使反應速率增加,而這類型的光分解反應不需加溫及加壓即可進行,其優點如下:
- 在反應過程所產生的中間產物,會持續被氧化,不具有毒性。
- 可在短時間把有毒之有機物完全礦化,實用性及可行性高。
- 催化劑價格低廉,經濟效益高。
|
Bond |
Energy |
Bond |
Energy |
Bond |
Energy |
Bond |
Energy |
|
|---|---|---|---|---|---|---|---|---|
|
Single Bonds |
||||||||
|
H — H |
432 |
N — H |
391 |
Si — H |
323 |
S — H |
347 |
|
|
H — F |
565 |
N — N |
160 |
Si — Si |
226 |
S — S |
266 |
|
|
H — Cl |
427 |
N — P |
209 |
Si — O |
368 |
S — F |
327 |
|
|
H — Br |
363 |
N — O |
201 |
Si — Si |
226 |
S — Cl |
271 |
|
|
H — I |
295 |
N — F |
272 |
Si — F |
565 |
S — Br |
218 |
|
|
N — Cl |
200 |
Si — Cl |
381 |
S — I |
~170 |
|||
|
C — H |
413 |
N — Br |
243 |
Si — Br |
310 |
|||
|
C — C |
347 |
N — I |
159 |
Si — I |
234 |
F — F |
159 |
|
|
C — Si |
301 |
F — Cl |
193 |
|||||
|
C — N |
305 |
O — H |
467 |
P — H |
320 |
F — Br |
212 |
|
|
C — O |
358 |
O — P |
351 |
P — Si |
213 |
F — I |
263 |
|
|
C — P |
264 |
O — O |
204 |
P — P |
200 |
Cl — Cl |
243 |
|
|
C — S |
259 |
O — S |
265 |
P — F |
490 |
Cl — Br |
215 |
|
|
C — F |
453 |
O — F |
190 |
P — Cl |
331 |
Cl — I |
208 |
|
|
C — Cl |
339 |
O — Cl |
203 |
P — Br |
272 |
Br — Br |
193 |
|
|
C — Br |
276 |
O — Br |
234 |
P — I |
184 |
Br — I |
175 |
|
|
C — I |
216 |
O — I |
234 |
I — I |
151 |
|||
|
Multiple Bonds |
||||||||
|
C=C |
614 |
N=N |
418 |
C≡C |
839 |
N≡N |
945 |
|
|
C=N |
615 |
N=O |
607 |
C≡N |
891 |
|||
|
C=O |
745 |
O2 |
498 |
C≡O |
1070 |
|||
|
(799 in CO2) |
||||||||
|
Average Bond Energies (kJ/mol) |
||||||||
綜合以上結論,我們可利用「直接光解」將紫外光直接照射N2O,進行初步的裂解,同時利用「間接光解」將紫外光照射通入之氧化劑,並產生激發態自由基與N2O進行間接裂解反應,提升處理效率。
紫外光應用於半導體製程尾氣N2O減量可行性
現有紫外光處理氣體技術
紫外光照射法為近年來處理氣體較新的技術,根據日本JP2000157621A與JP2001235201A的專利文獻分別提出了使用紫外光照射處理、消毒室內異味氣體的方法,但必須與光觸媒合併使用,且紫外光波長在315-400nm之範圍內除臭效果最佳。由於觸媒使用一段時間後容易失效,加上製程廢氣的濃度遠高於室內氣體,故未能將此方法應用在半導體製程尾氣處理中使用。
另外,UV/O3法是利用臭氧產生器生成具有高活性的臭氧與惡臭氣體中的無機分子發生反應,將其轉變為無臭味的NOX、SO2、SO3、H2O等小分子。中國專利 ZL00265091.6即為一種利用紫外光燈管產生臭氧進行滅菌、消毒與除臭味的實例。但在大風量、高風速的條件下,惡臭氣體通過臭氧產生器的時間過短,無法達到反應所需的時間。
紫外光技術處理N2O之可行性評估
由於以上這些紫外光應用於氣體的處理方法具有各自無法避免的缺點,長期以來並未被廣泛利用。因此,為了發展半導體N2O廢氣的處理方法和設備,需解決處理效率低、二次污染、佔地面積、運轉費用等技術問題。其應改善、克服的技術可行性評估有下列幾點:
- 將紫外光技術結合並改善現有電熱式Local Scrubber,提升處理效率,並克服空間限制與人力、金錢之耗費。
- 利用高能紫外光的光子能量大於N2O的結合鍵能為基礎,可先以「直接光解」將紫外光直接照射N2O,進行初步的裂解,因直接光解需要一定的照射時間,為避免部分氣流通過未與紫外光接觸反應,可同時藉由「間接光解」將紫外光照射通入之氧化劑(氧氣或其他氧化物),並產生大量激發態自由基與N2O進行間接裂解反應,使N2O分子鍵結在足夠的光能下斷裂而分解為N2,不必額外提供光觸媒即可達到處理效果,有效提升原有DRE 10~15%至90%。
- 根據local scrubber入口之N2O氣體濃度決定紫外光功率(W),可避免能源的浪費。
- 原有Local Scrubber第一段水洗程序,有助於去除通過紫外光照射前廢氣中之懸浮顆粒,充分發揮紫外光的效能。
- 原有;ocal Scrubber第二段水洗程序,有助於使通過紫外光照射後的氣體與激發態氧原子有足夠的反應時間,亦可去除N2O分解氧化後產生的NOX,避免二次污染問題之衍生。
由以上幾點技術評估,特殊UV燈管機構可安裝於電熱式;ocal Scrubber之各點進行測試,紫外光機構立體圖如 圖12所示,其中金屬容器的尺寸(截面積、體積等)、內部燈管數量及排列設計、氣流流速、如何增加氣體與光子相互碰撞的頻率等,都需要進行測試、評估及優化。
圖12、紫外光機構立體圖
結論
因應日漸備受重視之N2O造成之溫室效應與臭氧層破壞問題,國際巴黎協定及國內溫管法皆致力提出相關減量政策是未來的趨勢,如何不影響生產同時亦合法排放是台積電將面臨的問題。廠內目前無任何削減管制措施,其解決對策除了前段製程端針對N2O氣體用量提出減量或最佳化之外,廠務端對於De-N2O Local Scrubber之效率評估與改善亦為減量之重要方向。
本文主要針對有N2O來源之CVD與DIFF製程廢氣使用的電熱式Local Scrubber,進行紫外光技術結合應用之可行性評估,根據文獻指出,紫外光可直接破壞N2O鍵結,也可藉由氧原子自由基間接將N2O裂解為無毒的氮氣與氧氣。未來此技術發展方向將與Local Scrubber供應商及學術界合作研發,進行紫外光燈管模組設計、能量測試、腐蝕測試、Local Scrubber機構設計更改、機台安裝測試等,並透過工研院等公正檢驗機構進行相關效率測試,進行數據分析與安全性評估,以達紫外光應用於電熱式Local Scrubber削減N2O可行性評估程序之完整。
參考文獻
- 行政院環保署發布,「2015年中華民國國家溫室氣體清冊報告」,民國104年2月26日。
- IPCC Fourth Assessment Report: Climate Change 2007 (AR4).
- Ravishankara, A. R.; Daniel, J. S.; Portmann, R. W. (2009). "Nitrous Oxide (N2O): The Dominant Ozone-Depleting Substance Emitted in the 21st Century". Science 326 (5949): 123–5)
- “Drawing Down N2O to Protect Climate and the Ozone Layer”, United Nations Environment Program (UNEP) report (November 2013)
- Meunier, L., Canonica, S. and von Gunten, U. (2006),“ Implications of sequential use of UV and ozone for drinking water quality”, Water Research, Vol. 40, No. 9, pp. 1864-1876.
- Lin, A. Y.-C., Lee, W.-N., & Wang, X.-H. (2014). Ketamine and the metabolite norketamine: Persistence and phototransformation toxicity in hospital wastewater and surface water. Water Research, 53, 351-360.
- Schwarzenbach, R. P., Gschwend, P. M., & Imboden, D. M. (2005). Environmental organic chemistry. John Wiley & Sons.
- Lin, A. Y.-C., Lin, Y.-C., & Lee, W.-N. (2014). Prevalence and sunlight photolysis of controlled and chemotherapeutic drugs in aqueous environments. Environmental Pollution, 187, 170-181.
- Schlesinger, W.H. 1997. Biogeochemistry: an analysis of global change. 2nd edition. Academic Press, California.
- T. Rahn, M. Wahlen, G.A. Blake & H. Zhang, 1998. Stable Isotope Fractionation during Ultraviolet Photolysis of N2O, CA.
- Watanabe, K., Inn, E.C.Y. and Zelikoff, M. (1953). Absorption coefficients of several atmospheric gases. Geoph. Res. Papers No. 21, 1-80.
- Prasad, R. and Power, J.F. (1995) Nitrification Inhibitor for Agriculture, Health and Environment. Advances in Agronomy, 54, 233-281.

留言(0)