摘要

創新氨氮廢水資源化
Keywords / Ammonia Nitrogen Wastewater,Hydrogen Peroxide2,Membrane Degasifier2,Ammonium Sulfate5
半導體事業所排放的廢水常含有高濃度的氨氮與雙氧水,具有高污染濃度、高生物毒性等特性,依新制之放流水標準,對於氨氮廢水的處理是刻不容緩的。本文介紹以脫氣膜(MD)的處理方式,將廢水中的氨氮轉換為硫酸銨廢液,企圖將廢水處理轉為資源回收處理工法。然受限於台灣法規,工業廢液不可回收再利用為農用肥料;除將硫酸銨廢液直接乾燥為工業級硫酸銨回收再利用外,另可將回收的硫酸銨廢液提煉出25%氨水,再次作為工業級用途,且在提煉氨水同時亦可產生石膏板回收再利用。
前言
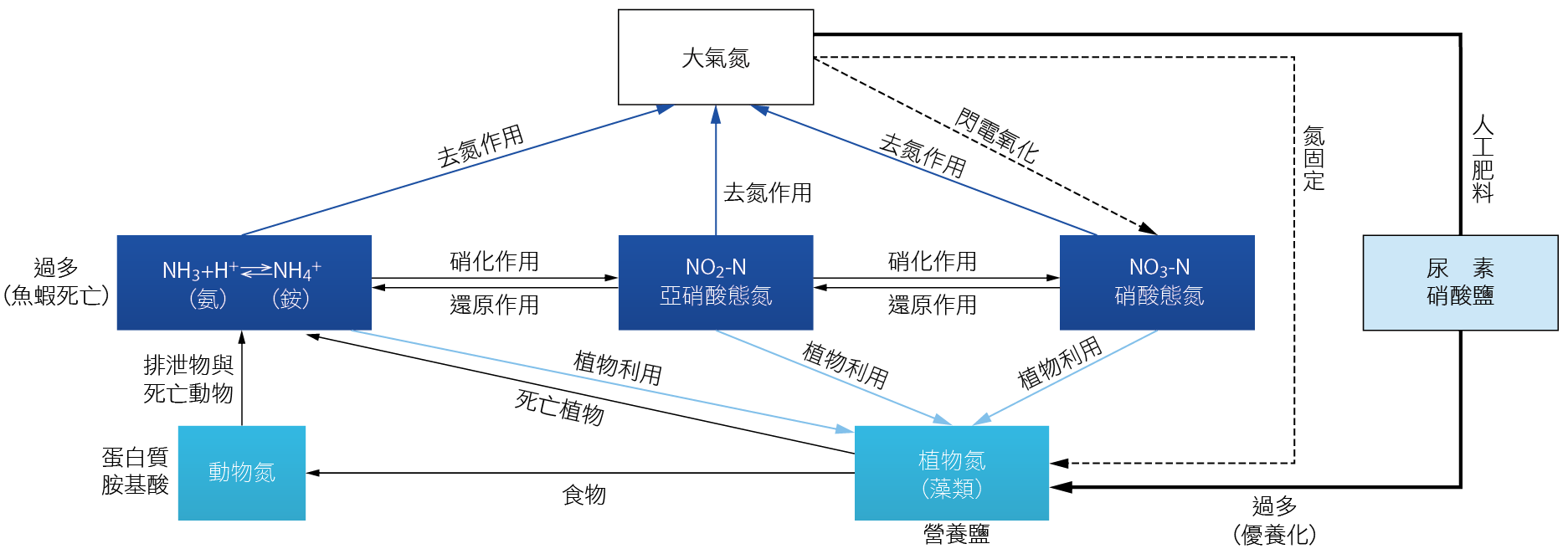
氮在廢水中以分子態氮、有機態氮、氨態氮、硝態氮、亞硝態氮以及硫氰化物和氰化物等多種形式存在,而氨氮是最主要的存在形式之一。檢視自然界氮循環與失衡污染影響(如 圖一),亞硝酸鹽是氨轉化為硝酸鹽過程中的中間產物,亞硝酸鹽對魚、蝦的毒性較強,當水中亞硝酸鹽濃度積累到0.1毫克/升後,魚、蝦紅細胞數量和血紅蛋白數量逐漸減少,血液載氧能力逐漸減低,而造成魚、蝦慢性中毒; 同樣地,當水中的未解離氨(NH3)大於1 ~ 2 毫克/升時,短時間內就可使水產動物產生急性氨中毒,會抑制中樞神經系統代謝能量的產生,使魚類產生抽搐、失去平衡,甚至昏迷的症狀。正常養殖水體氨氮一般不超0.2毫克/升為宜。嚴重時會使水中溶氧量下降,魚類大量死亡,甚至會導致湖泊的乾涸滅亡。另外,營養鹽類之物質過多,會引起水中藻類及其他微生物大量繁殖,形成優養化。且這些污染會造成飲用水的異味外,也會增加給水消毒殺菌處理過程中的用氯量,甚至影響飲用水源之水質,使自來水處理廠運行困難。有鑑於此,環保署修訂放流水標準增列氨氮標準。
圖一、自然界氮循環與失衡污染影響
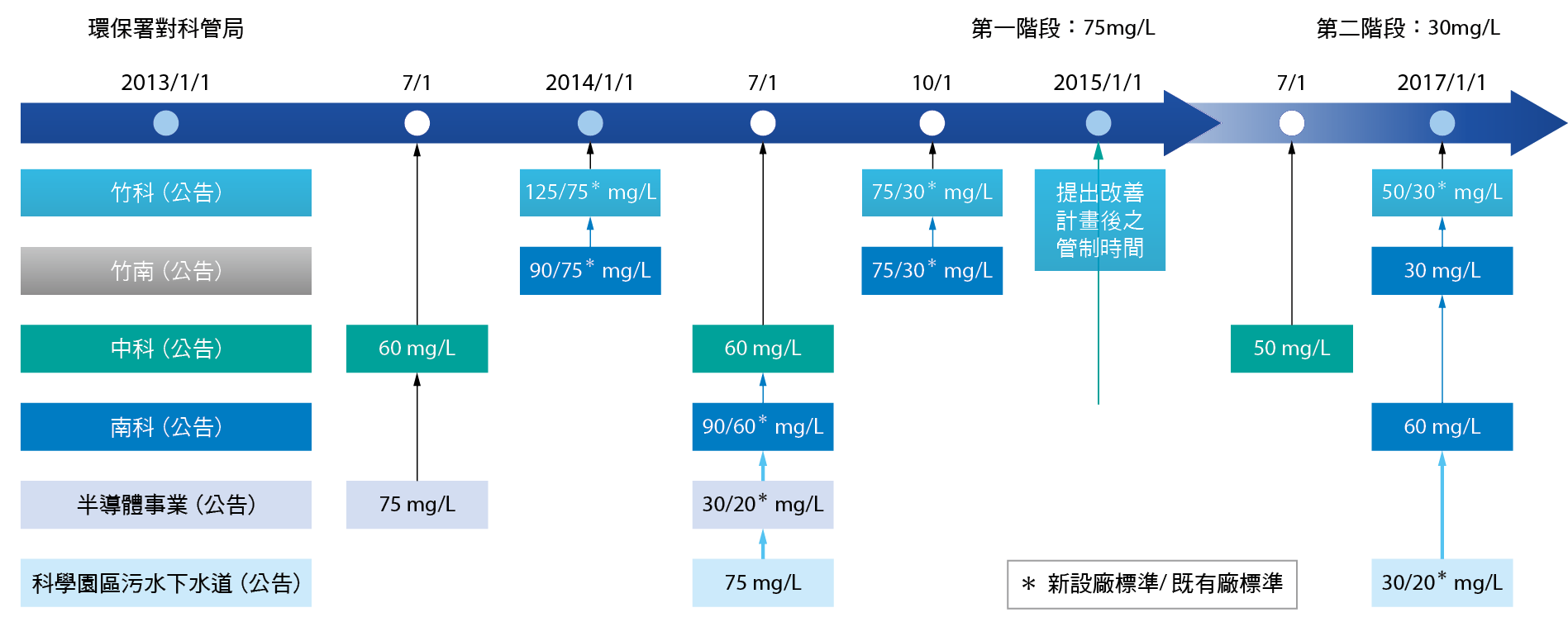
針對放流水氨氮排放現況最新的調查結果顯示,高科技產業因使用大量含氮化學藥品,其氨氮排放總量推估約佔全國總量之34%。同時針對光電材料元件與科學工業區下水道進行氨氮污染濃度進行分析,發現單一廠其排放納管氨氮濃度最高可達數百毫克/升,此結果顯示高科技產業之氨氮廢水排放比例與檢測值確實偏高,需要進行妥善管制。因此,環保署發布「晶圓製造及半導體製造業放流水標準」、「光電材料及元件製造業放流水標準」與「科學工業園區污水下水道系統放流水標準」等,皆已將氨氮納為科技業之管制項目,將分階段進行管制,並訂定光電材料及元件製造業、科學工業園區污水下水道系統之放流水標準。
圖二、各科學園區管理局氨氮法規管制時程與限值
氨氮廢水來源
在半導體業常用之含氨氨化學品,氨水、顯影劑TMAH、蝕刻液氟化銨和去光阻劑為主要氨氮廢水之來源,如 表一所示。依據環保署101年事業廢水特性調查及污染管制措施研議計畫調查,各科學園區廢水處理廠含氮物質濃度,如 表二所示。原廢水氨氮濃度某園區甚至高達1020 mg/L,硝酸鹽氮大多數小於50 mg/L;總氮主要來自氨氮濃度之貢獻,某園區亦高達1100 mg/L。如此可見,工業廢水氨氮污染之嚴重。
|
名稱 |
氨氮濃度ppm |
現況處理方式 |
俗名 |
化學名稱 |
|---|---|---|---|---|
|
NMD-W (2.38%) |
3,662 |
收集系統 |
顯影液 |
氫氧化四甲銨 |
|
NH4OH,29% |
116,000 |
處理系統 |
氨水29% |
氫氧化銨 |
|
正光阻去除液 |
微量 |
廢液委外 |
STRIPPER |
|
|
聚合物洗淨物 |
微量 |
酸鹼中和 |
- |
氫氧化四甲銨 |
|
二氧化矽蝕刻液 |
113,514 |
HF處理系統 |
- |
氫氟酸、氟化銨 |
|
光阻清潔液 |
32,941 |
酸鹼中和 |
- |
界面活性劑 |
|
園區 |
氨氮 mg/L |
硝酸鹽氮mg/L |
總氮 mg/L |
|
|---|---|---|---|---|
|
竹科 |
A園區 |
原廢水45.9-99.4 放流水55.7-111 |
原廢水4.9-20.0 放流水2.3-4.7 |
原廢水20.3-116 放流水61.1-124 |
|
B園區 |
原廢水54-130(一期) 放流水47.6-107 (D01) |
原廢水5-31(一期) 放流水10-38 |
||
|
C園區 |
原廢水186-1,020 放流水209-765 |
原廢水0.2-58.3 放流水8.4-44.0 |
原廢水254-1,100 放流水271-973 |
|
|
中科 |
D園區 |
原廢水13.2-126 放流水16.2-95.8 |
原廢水3.9-15.7 放流水4.3-22.9 |
- |
|
E園區 |
原廢水107-224 放流水104-207 |
原廢水0.81-17.6 放流水0.59-29.8 |
原廢水125-196 放流水80.1-205 |
|
|
南科 |
H園區 |
原廢水60.2-90.4 放流水56.0-94.7 |
原廢水3.1-14.1 放流水1.3-15.0 |
- |
|
I園區 |
原廢水2.1-55.9 放流水0.46-20.5 |
原廢水6.8-19.6 放流水4.5-17.3 |
- |
|
氨氮廢水處理方法簡介
整體而言,氨氮廢水處理方式可分為生物處理、物化處理、化學加藥處理等三大方式,而其副產物或終端產物大致可分為N2、NO3-、(NH4)2SO4、MgNH4PO4、NH4OH等等。其常見之處理方式大約有以下幾種方式,如 圖三所示。
圖三、氨氮廢水各種處理方式
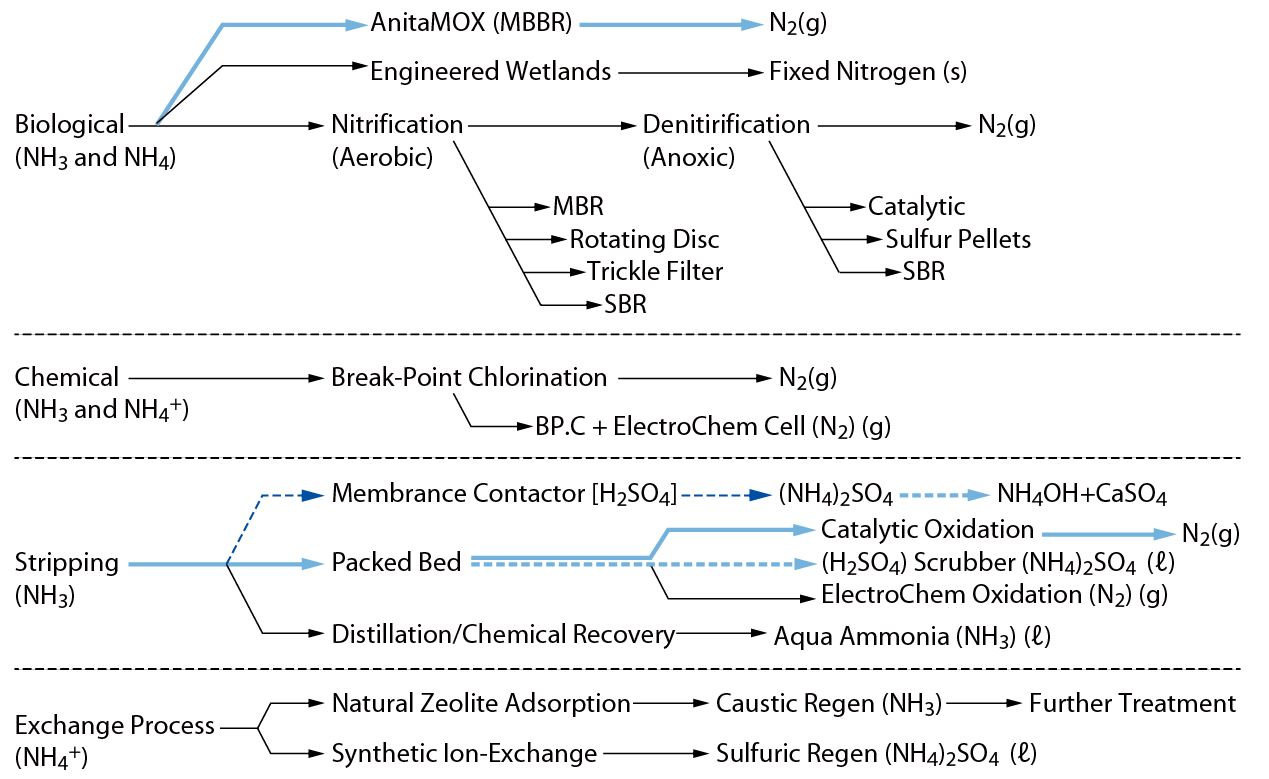
生物處理
硝化脫氮(AO、SBR等)、Anammox、生化混合、濕地法。
化學加藥處理
折點加氯、電化學沉降、高級氧化。
物化處理
含NH3氣提與 NO4+離子交換方式處理。
- NH3氣提:脫氣膜(液相交換)、氣提濃縮、觸媒燃燒、液膜法、電透析、循環冷卻脫氮、濕壁塔。
- NO4+離子交換:離子交換、沸石吸附、RO分離。
早期廢水中使用較普遍的氨氮處理方式為折點加氯、硝化脫氮之生物處理;但,近幾年來因應氨氮廢水組成、處理效率以及佔地面積,處理方法發展為脫氣膜(液相交換)、氣提濃縮、觸媒燃燒… …等方式,其適用性及初設成本也大不相同,如 圖四所示。
圖四、各種含氨氮廢水處理方式適用性及技術成熟度比較

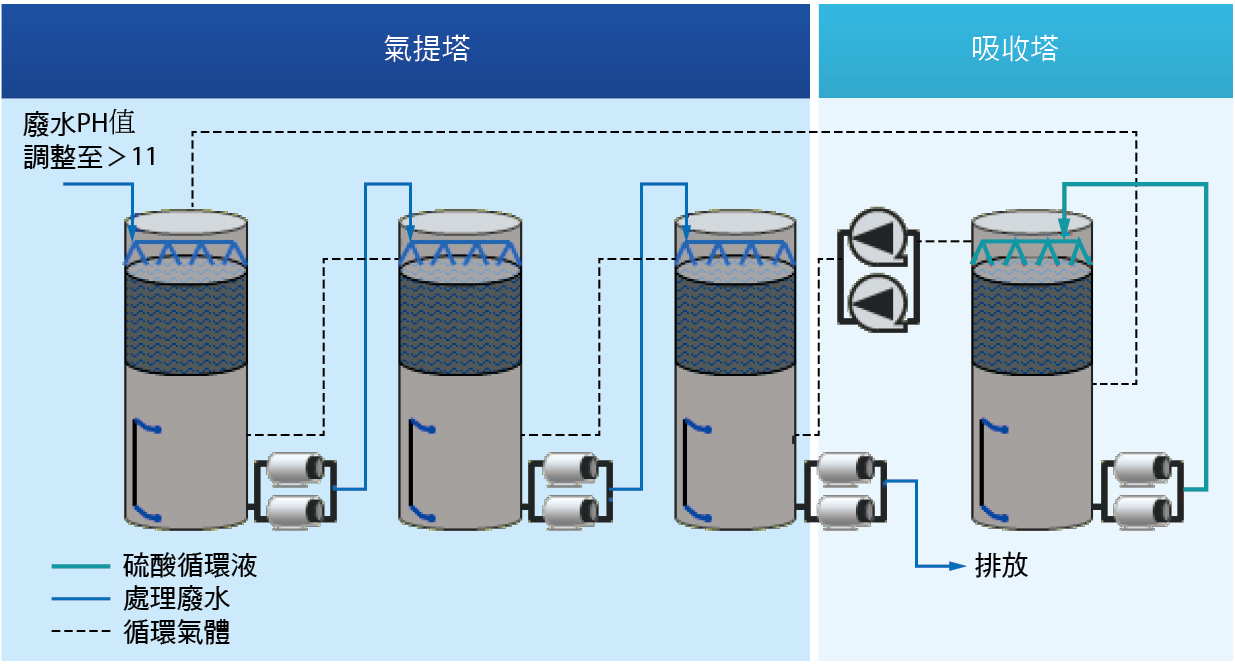
針對氨氮廢水以氣提脫除及吸附方式濃縮產生硫酸銨之方式概述如下。典型氣提脫除方式的特點:利用硫酸作為吸收液,並產生硫酸銨的副產物;其優勢為技術成熟且穩定。惟副產物的再利用,目前於台灣並不普及。傳統式氣提塔處理氨氮流程如 圖五所示。此方法流程簡單,處理效果穩定,建設費和運行費較低。但必須注意是否易生成水垢,因為在大規模的氨吹脫、氣提塔中,生成水垢是一個嚴重的操作問題。同時,為了防止吹脫出的氨氮造成二次污染,需要在氣提塔後設置氨氮吸收裝置。
圖五、傳統式氣提塔處理氨氮流程
十年來,脫氣膜製造商發展出有別於氣提塔(stripper)之液相-氣相之液相-液相的吸收方式。其特點為初設成本與佔地面積較少、操作方便、系統管路最短,且無氨氣逸散等問題。傳統的氣提塔,因考量質傳的效率,一般而言所需高度約7~15m,而脫氣膜的方式含操作的空間,設置單層的脫氣模組則僅需約1.5~2m,因此處理的設備可設置於室內。硫酸溶液與NH3(g)反應形成硫酸銨的示意圖如 圖六。NH3(g)在經薄膜與硫酸結合過程中,可產生25%~32%硫酸銨濃度。
圖六、使用脫氣膜作為氨氮吸收載體時液相—液相交換情形
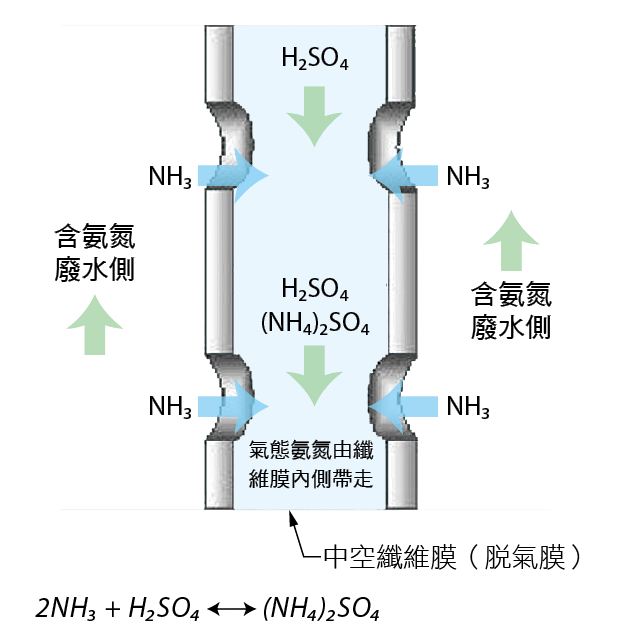
而且,以脫氣膜的技術來處理廢水中的氨氮,近年來在國外被廣泛的應用,因為低成本高效率之緣故,在此製程中的氨氣相,是透過膜和化學品液相中產生反應,氨的氣相出現短暫,幾乎不會造成洩漏的危害,以廢水處理而言,是較安全的製程,因較高的pH水質,可利用中和後再使用RO膜等技術來去除水中的鹽類,以得到較佳的水質,使得水回收再利用得以實現。
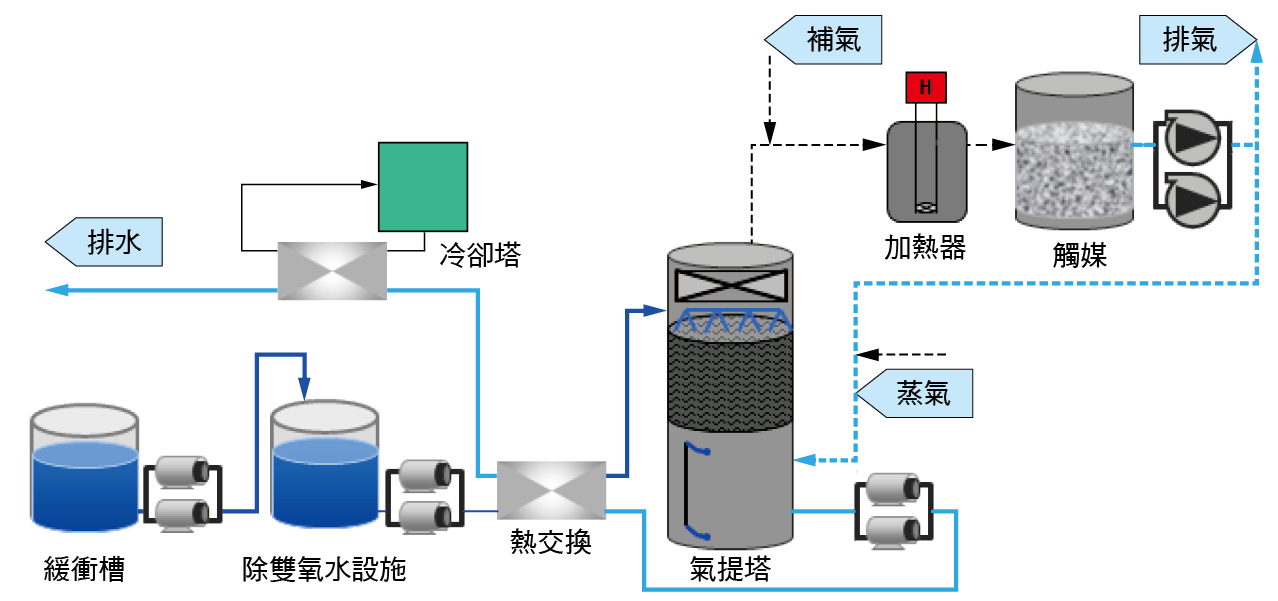
另亦可以觸媒分解方式,將水體中的氨氮氣提轉為氨氣後,再經觸媒塔進行分解為氮氣。其特點為,廢水中的氨氮經過了液相傳輸之氣相後,再經由觸媒進行裂解。一般而言,氨氮可直接經由加熱進行裂解,惟所需的溫度較高(> 800℃),較為耗能,利用觸媒降低裂解氨氮的活化能,使其能於約350℃進行反應,同時觸媒能經由氨氣的裂解中獲得部份的熱能配合系統內部的熱回收設備維持,且可因此反應在連續進流時,可以持續的進行氨氣的分解作用,其簡易流程如 圖七所示。
圖七、氨氮經觸媒分解系統簡易流程圖
硫酸銨廢液回收原理與流程
半導體廠氨氮廢水資源化回收再利用,主要分為廠內系統的水回收系統並建置脫氣膜系統:產出硫酸銨(如 圖八);與廠外系統:氨水製造與精製純化系統,再製為氨水/硫酸鈣,如後敘。
圖八、氨氮廢水回收與處理簡易流程圖
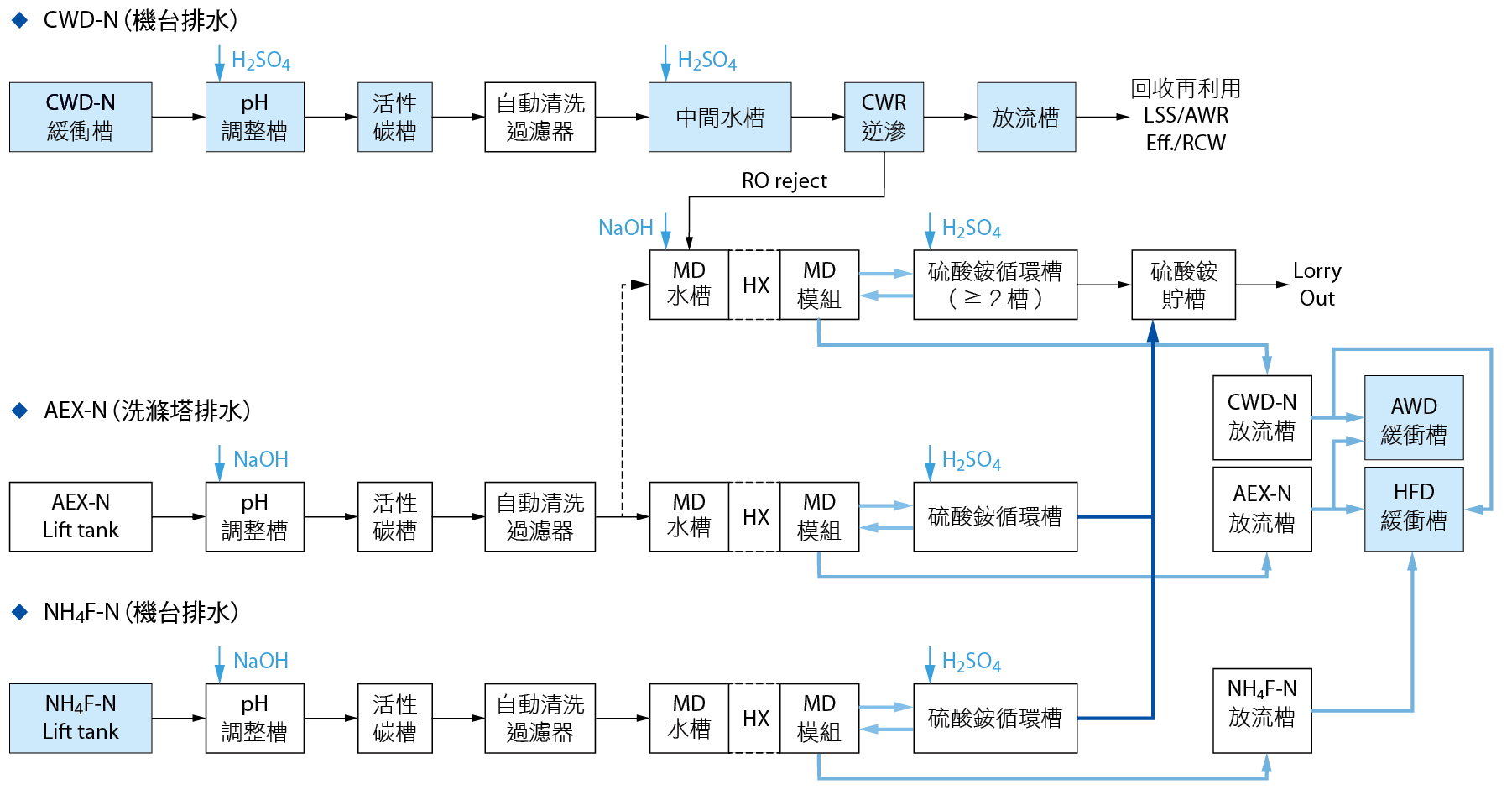
廠內的氨氮廢水處理系統主要包含:機台排放之鹼性廢水回收處理系統、鹼性洗滌塔排放廢水處理系統及機台排放之氟化銨廢水處理系統。其中主要處理單元包含:活性碳去除H2O2單元、逆滲透單元、脫氣膜與硫酸銨循環槽單元、硫酸銨清運槽。
廠內氨氮廢水處理系統,首先以活性碳去除H2O2以保護後續的處理滲透膜組水回收設備。應用活性碳進行H2O2催化的機制包含:直接催化(direct catalysis)及間接催化(indirect catalysis),詳細請參閱新工季刊第七期“半導體廠鹼性廢水的回收與資源再利用技術”(丁瑞華、陳國益)。
經活性碳去除H2O2之廢水,再接著以RO滲透膜組進行水回收。將RO操作在pH<6.5,此時未解離氨(NH3)不會釋出,絕大數以溶解態之銨離子存在於液態中,此時以逆滲透RO可去除水中的銨離子及其他的不純物,針對廢水中氨的去除率可達99%以上,滲透水可作為次級用水外,亦可更進一步再次純化回到純水前處理系統,作為純水未來水源之一。
銨離子在RO單元濃縮水側被濃縮成原來濃度的6~7倍高濃度氨氮廢水,利用亨利定律(Henry's Law),利用氨氮的氣相濃度和液相濃度之間的氣液平衡關係,將其pH調高大於10.8以上,在鹼性環境的NO4+-N將轉變為NH3(g)進行分離。
氣體在溶液中之溶解性質與氣體的分壓有關,可由亨利定律來說明:在常溫下,某氣體溶解於某溶劑中的體積莫耳濃度和該溶液達成平衡的氣體分壓成正比。亨利定律的公式可表示如下:
ep = ekc
其中:
e: 近似於2.7182818,是自然對數的底數;
p: 指溶液上的氣體分壓(partial pre-ssure);
c: 是溶液的體積莫耳濃度(molar concentration);
k: 則是亨利常數,k會因溶劑和溫度的不同而變化。(k的常用單位是atm•L•mol-1或Pa•m3•mol-1)
當溫度愈高,氨氣在水中之溶解度愈低,蒸氣壓愈高,如 圖九所示。
圖九、NH3 於不同溫度時於水中的形態

另外,pH會影響銨離子在水中的平衡,當高溫、高pH將有利於氨以氣態存在。利用高pH值,將銨離子轉變為氣態氨氣,穿越非極性薄膜,將與H2SO4反應形成硫酸銨;利用一至多段之脫氣膜MD,並調整廢水和硫酸兩者流速上的比例,可達到99%的氨去除率及得到高濃度的30%硫酸銨溶液外運,作進一步的資源化處理。詳細請參閱新工季刊第七期“半導體廠鹼性廢水的回收與資源再利用技術”(丁瑞華、陳國益)。
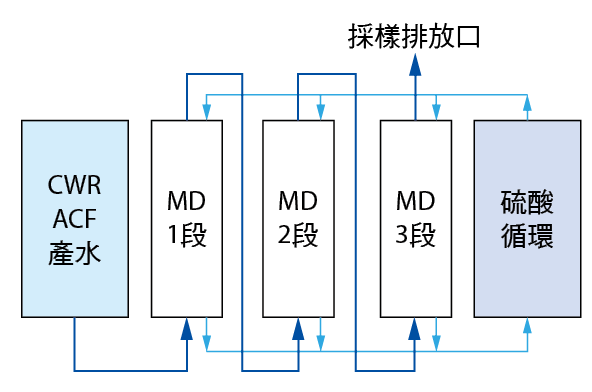
為確定系統運轉後實驗可靠性,以膜面積之相對流量做相對實驗,並確認最後處理去處率及硫酸銨濃度。如採用6"MD(膜面積:42m2)實驗模組(如 圖十),單位廢水流通量可達0.95 CMH,即實廠14"MD(膜面積:220m2)單位廢水流通量設計值為5CMH。
圖十、氨氮脫氣膜測試機組

實驗模組流程如 圖十一。
圖十一、氨氮脫氣膜實驗模組流程圖
經廠外脫氣膜組實驗 圖十一之結果顯示:單支脫氣膜一般可達90~95.5%氨氮去除率,如硫酸pH控制失當,去除率會下降至56.8%;串聯二支可提升去除率至95.5~99.3%,如 表三所示。
|
項次 |
pH |
CWR原水流量 |
硫酸流量 |
硫酸pH |
MD inlet |
1st MD outlet |
2nd MD outlet |
MD單支去除率 |
MD二支串聯去除率 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
pH |
NH3-N |
Cond |
NaOH (ml) |
pH |
NH3-N |
Cond (ms/cm) |
pH |
NH3-N |
Cond (ms/cm) |
|||||||
|
1 |
11.8 |
0.5 |
1 |
<0 |
11.80 |
2100 |
13.75 |
6000 |
|
140 |
13.92 |
|
10 |
13.98 |
92.9% |
99.5% |
|
2 |
11.8 |
0.5 |
1 |
<0 |
11.80 |
1900 |
|
|
|
105 |
|
|
4.75 |
|
95.5% |
99.8% |
|
3 |
11.8 |
0.5 |
1 |
2-3 |
11.80 |
1540 |
|
|
|
162 |
|
|
70 |
|
56.8% |
95.5% |
|
4 |
11.8 |
0.5 |
1 |
<0 |
12.05 |
2300 |
18.55 |
6500 |
12.04 |
100 |
18.34 |
12.05 |
10 |
18.29 |
90.0% |
99.6% |
另氨氮廢水與循環硫酸之流量比亦為重要之操作參數之一,如氨氮廢水與循環硫酸之流量比為1:2時(如 表四),串聯二支之氨氮去除率可達99.6~99.7%;當流量比降為1:1.5時(如 表五),串聯二支之氨氮去除率稍下降至98.4~99.3%。
|
項次 |
pH |
CWR原水流量 |
硫酸流量 |
MD inlet |
1st MD outlet |
2nd MD outlet |
第一段MD去除率 |
第二段MD去除率 |
串聯MD去除率 |
|---|---|---|---|---|---|---|---|---|---|
|
NH3-N |
NH3-N |
NH3-N |
|||||||
|
1 |
11.8 |
0.4 |
1.6 |
2200 |
130 |
8 |
94.1% |
93.8% |
99.6% |
|
2 |
11.8 |
0.4 |
1.6 |
2320 |
115 |
6 |
95.0% |
94.8% |
99.7% |
|
pH |
CWR原水流量 |
硫酸流量 |
MD inlet |
1st MD outlet |
2nd MD outlet |
硫酸 pH |
第一段MD去除率 |
第二段MD去除率 |
串聯MD去除率 |
|---|---|---|---|---|---|---|---|---|---|
|
NH3-N |
NH3-N |
NH3-N |
<0 |
||||||
|
11.8 |
0.5 |
1.5 |
5000 |
330 |
34 |
<0 |
93.4% |
89.7% |
99.3% |
|
11.8 |
0.5 |
1.5 |
2500 |
150 |
40 |
<0 |
94% |
73.4% |
98.4% |
故由以上實驗所得參數,據此設計廠內氨氮處理系統。
無論是傳統式的氣提塔或是脫氣膜的方式以硫酸為吸收液時,其副產物皆為硫酸銨,一般而言硫酸銨的用途為農業用肥料,惟依據台灣法規規定:經工業使用之硫酸銨無法製成肥料,只能乾燥後作為工業用途之硫酸銨。因此,另多種資源化的可能性須再開發,比如:將硫酸銨再製回氨水回去化市場作為工業用途,供應給空氣污染設備之排煙脫硝使用或其他工業化學品之原料。
將硫酸銨再製回氨水是透過簡易的硫銨分離程序,將銨離子經pH調整,再經由氣提塔轉化為高濃度的氨氣後,再經由純水循環吸收後,可再製為20%以上的氨水。
其反應方程式如下所示:
2NH3(g)+H2O (需維持低溫)→NH4OH(aq)
這種氨水再製的程序又被稱為氣提吸收法。有別於氣提脫除方式為其吸收液為純水而非硫酸。其流程如 圖十二所示。
圖十二、硫酸銨轉為氨水簡易流程圖
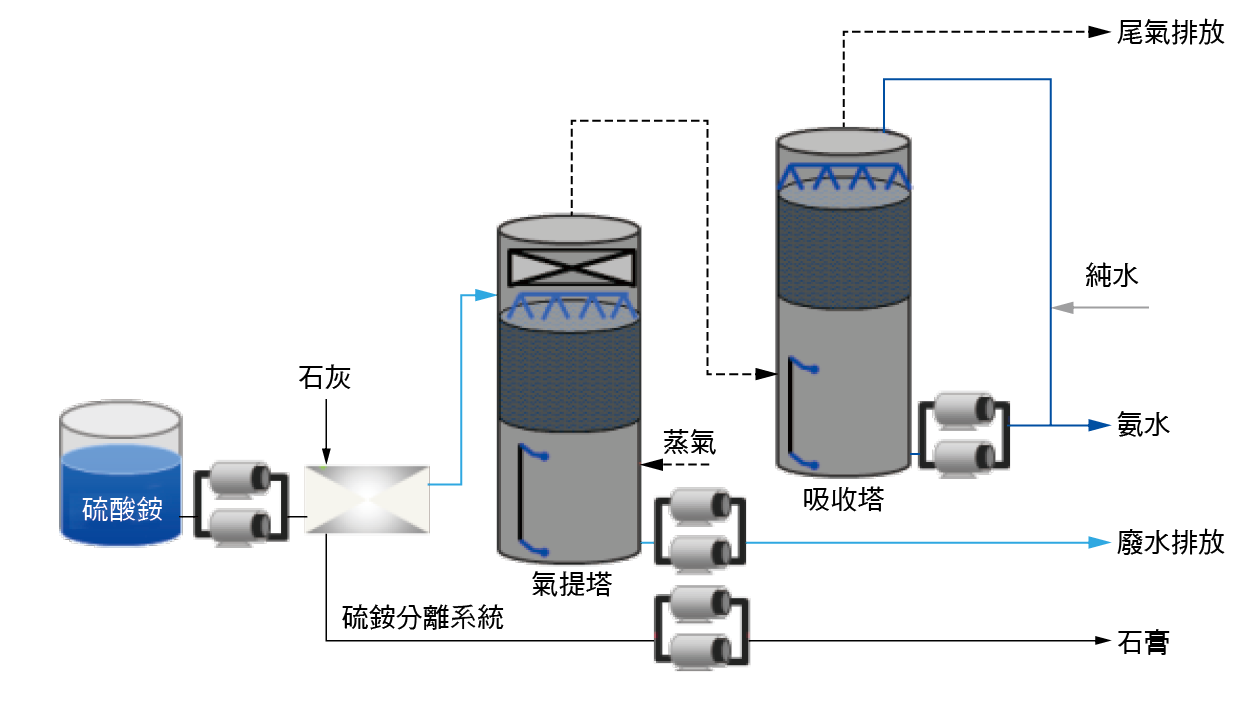
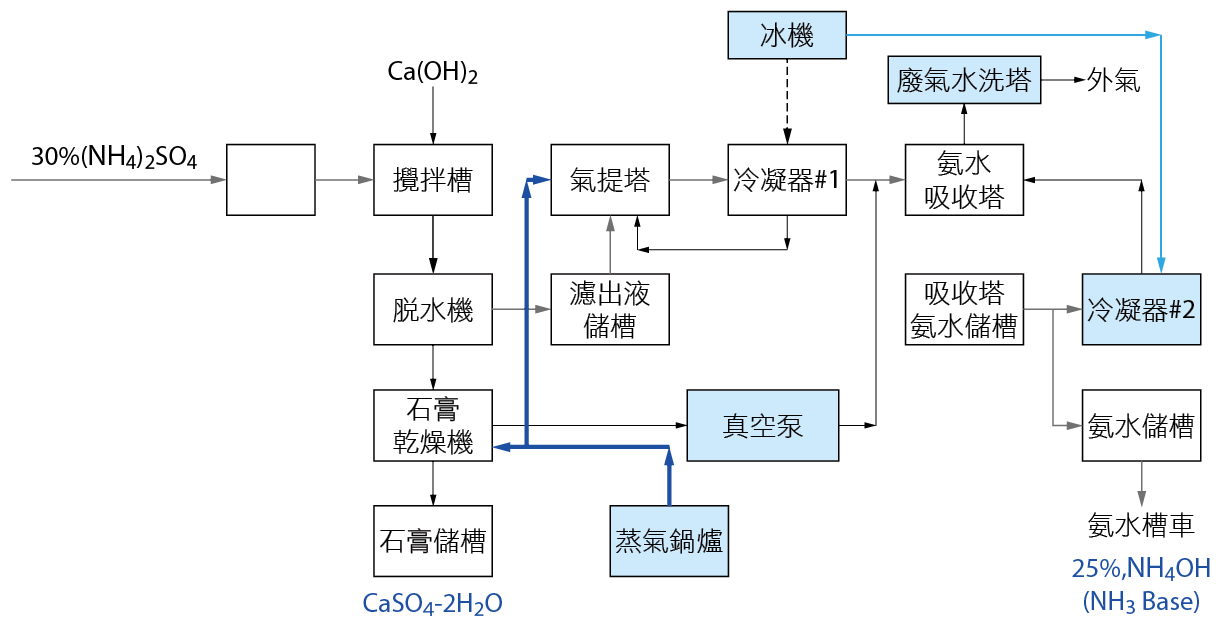
因此,Off site的處理方法與流程主要在考量:去化產品之通路、操作的經濟性,與產品的高品質要求等。因此有回收商發展:將硫酸銨之銨的部分:回製氨水外,並將硫酸銨之硫酸的部分:生產石膏板(硫酸鈣)。流程主要概念是將硫酸氨添加熟石灰的處理程序,第一階段先添加消石灰調整硫酸氨酸鹼值將硫酸氨變成氨水及硫酸鈣,第二階段再以蒸餾純化提濃成25%的氨水,供工業用途使用。
將工廠回收之高濃度硫酸銨廢水,與氫氧化鈣(俗稱消石灰),在混合攪拌槽反應,會生成硫酸鈣(CaSO4•2H2O),(俗稱石膏)及氨氣(NH3)。有關(NH4)2SO4+Ca(OH)2之反應機制,如PENG-Xiao-yu等人(Wang Yun-yan, et al., 2008)成所提出之硫酸鈣在pH=3.5-11時會有一最小溶解度0.411 g/L。當高pH時,Ammonia會轉為NH3 (氣態),將此帶有氨氣(NH3)之硫酸鈣溶液至石膏水過濾器進行過濾,濾餅以逆洗方式排出至石膏脫水系統脫水乾燥後銷售至石膏工廠回收,帶有氨氣的濾液加鹼中和殘留的硫酸根離子並經超過濾器過濾後,再抽至氣提塔進料槽。
將氨氣提塔進料槽帶有氨氣的濾液抽送到氨氣提塔,利用輸送至氨氣提塔的蒸汽提升濾液的溫度,濾液中氨會從液相揮發至氣相,達到氨氣氣提濃縮的效果。氨氣提塔塔底的液體則排放至廢水處理系統。
氨氣提塔塔頂經濃縮帶有氨氣的氣體送至氨吸收塔,利用輸送至氨吸收塔的冰水降溫並加超純水吸收氣相的氨氣生成氨水,再送至氨水貯槽存放並銷售至氨水工廠回收。
圖十三、Off site 氨水濃縮精製系統流程圖
結論
隨著科技日益進步人類對於環保的意識也逐漸重視,降低生產所排放的廢棄物對生態的影響為當前主要課題,因此政府將逐漸針對降低氨氮的廢水排放及生物急毒性之影響所採取新的措施,如可將氨氮廢水處理的同時,除回收處理水外,又將氨氮污染物創造為有經濟價值之副產品,如硫酸銨,可回收再利用將為最有效之解決辦法。但硫酸銨回收產品之銷售市場,一直是回收工作最頭痛的問題,依國內法規:氨氮廢水處理所產生之硫酸銨,屬於工業廢棄物,無法直接當做肥料來使用,只能回歸工業使用,但受限於原有市場容納吞吐量,與回收再利用產品之生產成本往往較新品原料來得高,卻無法直接反映成本於售價上,因此,開闢新產品將硫酸銨轉換為工業級氨水或電子級氨水,與產生副產品硫酸鈣(石膏板),將是回收再利用之新的里程碑,並且可以實現企業對環境保護的承諾、提昇企業形象及減少產品的碳足跡。
參考文獻
- 傅正貴、王俊元、李明利,氨氮廢水處理方式之探討專題報告(2013)。
- 朱敬平,EPA-101-G104-02-214事業廢水特性調查及污染管制措施研議計畫(2012)。
- 朱敬平,EPA-99-G104-02-215產業廢水污染調查及管制措施研議計畫(第二年)(2010)。
- 張芳淑,廢水氨氮處理與節水政策之結合(2013)。
- 新竹、竹南及龍潭園區下水道可容納排入水質標準(102年9月23日)。
- 環署水字第1000050497號。
- 環署水字第0990112348F號。
- 丁瑞華、陳國益,半導體廠鹼性廢水的回收與資源再利用技術,新工季刊Vol.07 (2012)。
- 陳鏡廉,兆聯實業股份有限公司氨氮廢水綠色循環再利用專題報告(2014)。
- Kenji Hagimori, Kawaguchi; Yuzuru Abe, Hanyu; Tetsuo Kanke, Misato, “METHOD OF DECOMPOSING HYDROGEN PEROXIDE” Physics. (1994)
- PENG Xiao-yu, WANG Yun-yan, CHAI Li-yuan, SHU Yu-de, "Thermodynamic equilibrium of CaSO4-Ca(OH)2-H2O system” (2008)
- Edward P. Fleming, Melville F. Perkins, 1939,"PRODUCTION OF AMMONIA FROM AMMONIUM SULPHATE".
- 氨氮脫氣膜測試機組照片與測試結果報告(由兆聯公司提供)。



留言(0)