摘要

談放流水生物急毒性之研究
Keywords / Acute Toxic Unit (TUa),Toxicity Reduction Evaluation (TRE),Toxicity Identification & Evaluation (TIE)
本文主要分析半導體廠廢水生物急毒性潛在問題,建立主要毒性物質之管制標準,以作為毒性之減量量及處理理方法選用依據。目前放流水生物急毒性標準檢測方法需48至96小時才能得知急毒性數值,本研究期能即時掌握放流水質狀況,維護良良好的水體環境。經清華大學化學系協助檢測分析結果,建議目標水質建議修正至(Cu2+、Conductivit、H2O2、NaOCl分別為0.1 mg/L,7,000 µS/cm, 4 mg/L, 0.15 mg/L) 。未來可依據此結果建立不同水質呈現的急毒性進行分析,利用這些水質參數,以預估急毒性數值,即時掌控放流水質狀況,以降低放流水之急毒性。
前言
目前有關水質之相關檢測主要分類如 圖1,先進國家如美國、加拿大、德國等為了彌補有關前述水質化學分析測試上之不足,且基於保護環境水體之目的,紛紛建立「放流水生物毒性測試方法」,美國環保署首先發展出全放流水毒性測試方法 (Whole Effluent Toxicity Method, WET)[2],利用此方法可監測放流水對水中生物所造成的毒性。
圖1、環境檢測之分類
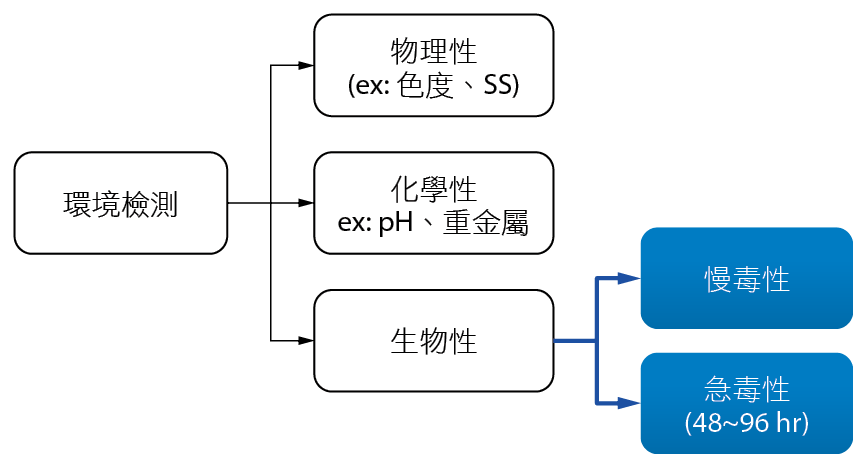
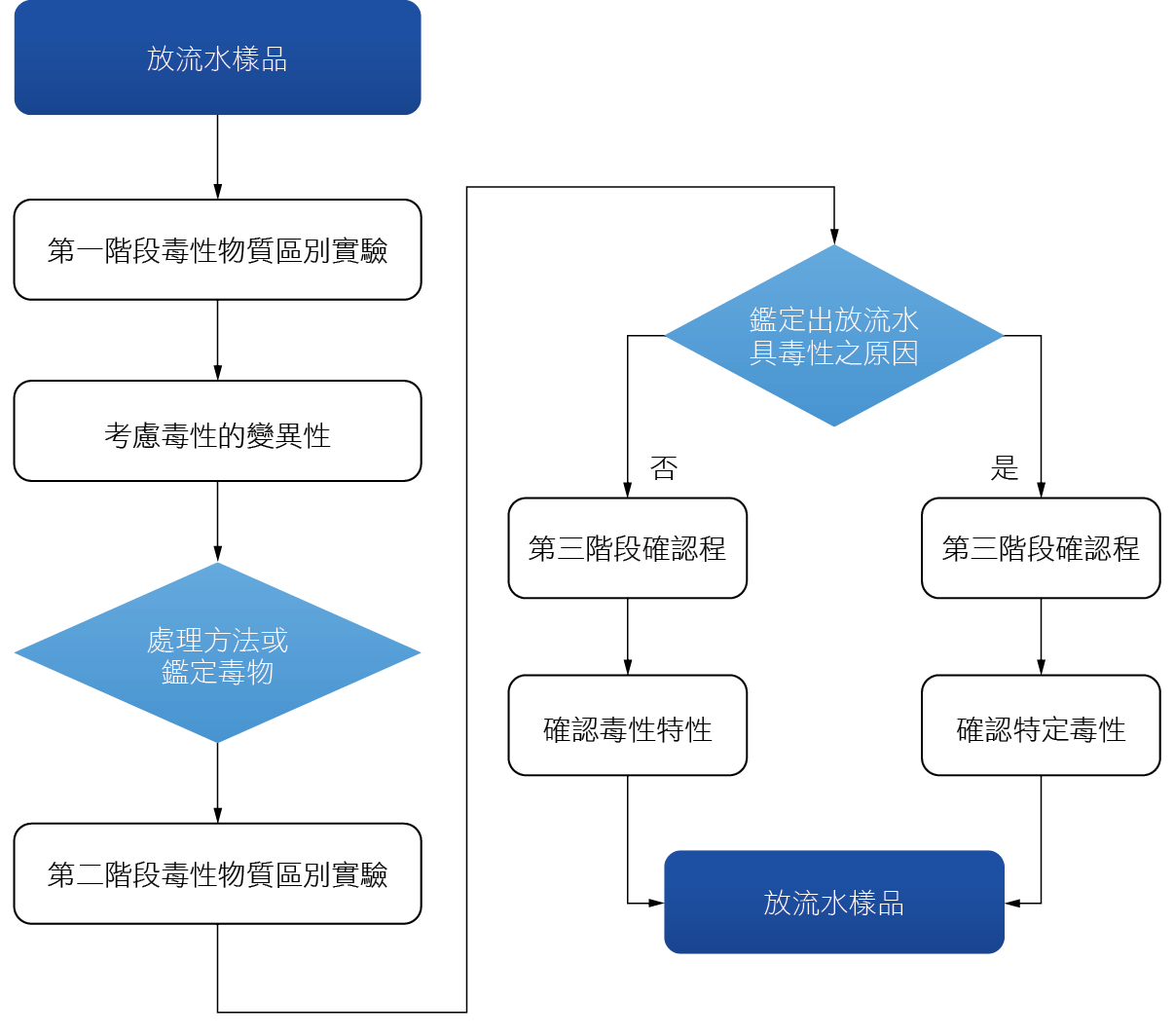
生物急毒性效應分級如 表1,試驗檢測結果可用以評估放流水對水中生物可能產生的危害,進一步進行放流水毒性鑑定評估 (Toxicity Identification Evaluation, TIE) 圖2流程,找出放流水中所含毒性物質,以作為放流水毒性減量(Toxicity Reduction Evaluation, TRE)及處理方法之選用依據。
|
LC50(%) |
TUa |
毒性強度 |
|---|---|---|
|
< 25 |
> 4 |
極毒性(Very Toxic) |
|
26-50 |
2-3.9 |
中急毒性(Moderately Toxic) |
|
51-75 |
1.33-1.9 |
急毒性(Toxic) *管制標準:1.43
|
|
76-100 |
1-1.32 |
微急毒性(Slightly Toxic) |
|
> 100 |
< 1 |
無急毒性(Nontoxic) |
圖2、美國EPA 放流水毒性鑑定評估流程[4]
隨著製程的特性,高科技廠之放流水成分極為複雜,不易直接以毒性試驗檢測出單一毒物,因此毒性鑑定評估係利用物理、化學處理技術對水樣作初步的分離,再將分離出的溶液,利用化學分析方法配合生物檢測技術,鑑定水中毒性物質的種類及濃度。放流水毒性鑑定評估流程可分為毒物特性試驗、毒物鑑定試驗與毒物確認試驗等三階段,其TIE三階段流程,可遵循此評估流程鑑定出放流水水體中之毒性因子之影響,進而進行毒性減量計畫,維持良好的放流水體環境。
美國環保署以急毒性單位(Acute toxic unit, TUa)為生物毒性指標(1),係指為半數致死濃度(Lethal Concentration 50%, LC50)或半抑制有效濃度(Effective Concentration 50%, EC50)之倒數。
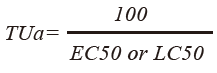 ............(1)
............(1)
EC50或LC50越低,TUa值越大,則毒性就越高,其生物毒性效應分級表如 表1,可以反映放流水對水生生物之影響。TUa大於4時屬於極毒性(very toxic),TUa介於2-3.9間屬中毒性(moderately toxic),當TUa等於1.33-1.9屬毒性(toxic),TUa為1-1.32屬於微毒性(slightly toxic),當TUa小於1則可定義為不具急毒性(nontoxic)。而環保署對於半導體廠的放流水管制標準為1.43。
背景緣由
環保署於99年12月15日修正發布放流水標準,主要修訂內容為增訂「光電材料及元件製造業」及「石油化學專業區以外之工業區」內之科學工業園區污水下水道系統之放流水標準管制項目與限值。除原管制生化需氧量、化學需氧量、懸浮固體及真色色度外,增訂銦、鎵、鉬、總毒性有機物及生物急毒性(TUa)。
科技部中部科學工業園區管理局於2014年10月公告,污水下水道系統納管水質標準及使用費之水質分級、分級費率、計算公式、收費項目及單價表。內文更規定生物急毒性檢測申報及其收費標準,當TUa異常2次,污水下水道使用費收費以1.5倍計。2015年11月科技部中部科學工業園區管理局公告將罰則移除,排除TUa不合格之收費標準,園區內廠商仍須每半年申報一次。故為符合目前放流水之生物急毒檢測,廠內須明確鑑定出放流水之毒性來源。
依據廠內放流水毒性鑑定,確認相關之特性,並對廠內來源做適當的減量, 表2為新竹科學工業園區廢水之汙染特性。
|
產業 |
污染特性 |
廢水量(CMD) |
|---|---|---|
|
積體電路 |
導電度、COD、BOD、TOC、氨氮、凱氏氮、總氮、正磷酸鹽、總磷、砷、TMAH、TTO、生物急毒性 |
數千 |
|
平面顯示器 |
導電度、COD、BOD、TOC、氨氮、凱氏氮、總氮、正磷酸鹽、總磷、砷、TMAH、TTO、生物急毒性 |
數千以上 |
|
發光二極體 |
導電度、COD、BOD、TOC、氨氮、凱氏氮、總氮、正磷酸鹽、總磷、砷、TMAH、TTO、生物急毒性 |
數百 |
|
太陽能電池 |
導電度、COD、TOC、氨氮、凱氏氮、總氮、生物急毒性 |
數百 |
|
製藥生技 |
COD、BOD、TOC、氨氮、凱氏氮、總氮 |
數百 |
|
生活污水 |
氨氮、凱氏氮、總氮、生物急毒性 |
數十 |
另相關產官學合作研究結果指出半導體製程排水之物質可能影響TUa的項目如 表3所示,包含溶氧(dissolved oxygen, DO)、導電度、NH3-N、TMAH與H2O2,其中溶氧對於脊椎動物的影響較無脊椎動物高;導電度部分則對無脊椎代表動物(水蚤)有較大的影響;NH3- N、TMAH和H2O2則對四種生物TUa的相關性皆高,又以鯉魚的敏感度為最高;此外,另有相關研究提出餘氯與Cu2+也會造成影響,而上述之物質皆與目前廠內所排放之廢水所含項目高度類似。
|
生物\水質項目 |
DO |
導電度 |
NH3-N |
TMAH |
H2O2 |
餘氯 |
Cu2+ |
|---|---|---|---|---|---|---|---|
|
水蚤 |
|
+ |
+ |
+ |
+ |
+ |
+ |
|
米蝦 |
|
|
+ |
+ |
+ |
|
|
|
鯉魚 |
+ |
|
++ |
++ |
++ |
|
|
|
羅漢魚 |
++ |
|
+ |
+ |
+ |
+ |
+ |
|
註:"+"代表相對相關性 |
|||||||
計畫方法
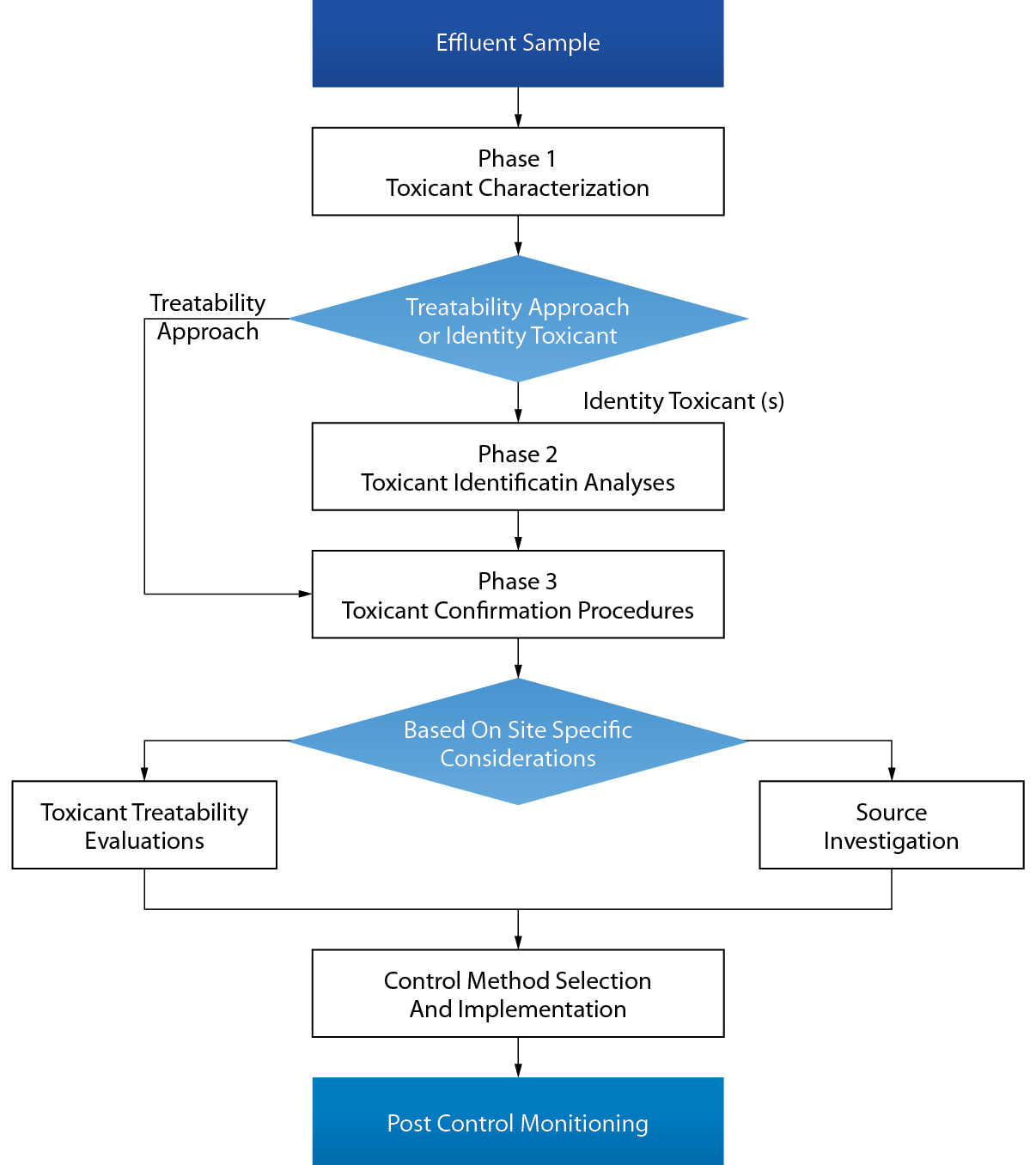
本放流水生物毒性目標限值符合性評估計畫,是委由清華大學完成相關放流水毒性鑑定之研究,以環保署環檢所參考美國環保署之毒性鑑定評估程序(TIE),完成放流水含過氧化氫(H2O2)、次氯酸鈉(NaOCl)、二價銅離子(Cu2+)及酵素(Enzyme)之放流水的生物毒性鑑定,藉以評估廠定放流水目標(Target)限值需符合法規納管水質生物毒性標準之適用性。
放流水毒性鑑定評估流程可分為毒物特性試驗、毒物鑑定試驗與毒物確認試驗等三階段,其TIE三階段流程(USEPA,1989a)如 圖3。
圖3、放流水毒性鑑定評估流程
第一階段:毒物特性試驗
該階段的主要工作目的是檢測水體中毒性物質於放流水樣品中的物理、化學性質,包含pH值的改變、可過濾性、溶解度、固體物質的分離與萃取等等。
第二階段:毒性鑑定程序
毒性鑑定程序是毒性鑑定評估(TIE)的第二階段,利用第一階段提供的毒物物理/化學特性鑑定出可能的毒物,再以更進一步的實驗方法或更精密之儀器來分離毒物種類,再由第三階段來確認毒物。第一階段的工作主要是將有毒物質的類別鑑定出來,第二階段則承接第一階段,其首要工作就是將有毒物質與無毒物質分離開來。雖然如許多儀器(如GC-MS、ICP-MS等)能讓我們一次鑑定出多種化學物質,但如同我們選擇以毒性為基礎的TIE而不選用傳統化學分析評估的原因一樣,我們無法在使用上述儀器鑑定出污染物的同時也得到毒性上的資料,因污染物間彼此會產生協同(Synergistic)、拮抗(Antagonistic)、加成(Addition)和增強(Potentiation)等不同毒性反應作用,一般不易單獨以個別物質的加成毒性,判斷其對承受水體生物之影響。所以除非在第一階段就已經提供足夠的資訊讓我們可以推斷出可能的毒物為何,否則就需要將毒物分離出來。在這個階段中,對於試驗結果的解釋上有一點須特別注意,即第二階段的試驗結果只允許我們「驗證假設」。因為在一般的實驗設計上,它們通常是被設計來驗證或排除一個假設的可能性,所以無法提供額外的推論來排除假設。
第三階段:毒物確認程序
經過第一和第二階段的毒物特性分析後,可能已找出單一毒物,亦可能只找出某一類的化學毒物而無法再細分出單一的物質,這些結果均可在第三階段找出較明確的答案,以下為幾種確認方式。
除現場測定pH值、導電度及溶氧度外,採樣完返回實驗室後即進行生物毒性試驗及相關之儀器檢測,並藉由改變放流水樣品中的物理化學性質,包括pH值、過濾性、溶解度、金屬離子的分離與非極性物質萃取等等,其目的在於尋找放流水中的毒性物質,以有效去除水樣毒性。一旦水樣經減毒程序完成後,就可以將標的毒物之原始濃度及目標限值濃度分別添加回去,計算其TUa來評估目標限值的生物毒性標準適用性。
為有效完成含過氧化氫、次氯酸鈉、二價銅離子及酵素之放流水的生物毒性鑑定,評估廠定放流水目標限值符合中科管理局納管水質生物毒性標準的適用性,工作流程規劃如 表4所示。
|
廢水處理方式 |
去除毒性物質種類或目的 |
|---|---|
|
初始毒性試驗 |
找出適當的曝露濃度,以利後續毒性試驗 |
|
基礎廢水毒性試驗 |
物化處理前後做比較,推測毒物的性質類型 |
|
漸次調整pH試驗 |
氨氮 |
|
毒物的溶解度及極性產生變化 |
|
|
改變金屬錯化合物的型式 |
|
|
過濾 |
固體物質 |
|
空氣曝氣 |
揮發毒性物質而減少毒性 |
|
易氧化性的成分 |
|
|
碳18固相萃取試驗 |
有機物質或極性較低之金屬鉗合物 |
|
還原試驗(硫代硫酸鈉) |
餘氯、過氧化氫、 |
|
陽離子交換樹脂 |
陽離子 |
|
沸石吸附試驗 |
+1價離子 |
其目的在於尋找放流水中的毒性物質,以有效去除水樣毒性。一旦水樣經減毒程序完成後,就可以將標的毒物之原始濃度及目標限值濃度分別添加回去,計算其TUa來評估目標限值的生物毒性標準適用性。
實驗結果
依據上述實驗檢測規劃,於廠區三個放流口採樣分析,其放流水水質如 表5所示。
|
採樣點編號 |
單位 |
S1-1 |
S1-2 |
S1-3 |
|---|---|---|---|---|
|
日期 |
2015.11.19 |
2015.12.3 |
2105.12.17 |
|
|
pH |
- |
6.85 |
6.61 |
6.59 |
|
電導度 |
mS/cm |
7.26 |
5.94 |
8.04 |
|
溶氧度 |
mg/L |
13.6 |
12.9 |
11.7 |
|
懸浮固體 |
mg/L |
10 |
4 |
10 |
|
氨氮 |
mg/L |
19.9 |
36.6 |
41.4 |
|
水硬度 |
mg CaCO3/L |
391.6 |
267 |
269 |
|
H2O2 |
mg/L |
1.5 |
0.09 |
210 |
|
NaClO |
mg/L |
0.06 |
0.03 |
0.09 |
S1-1放流口經不同物化處理後之毒性特性試驗結果如 表6所示。
|
測試項目 |
Daphnia magna 48hr-LC50(%) |
Pseudorasbora parva 96hr-LC50(%) |
|---|---|---|
|
初始毒物試驗 |
10.34 % |
>100 % |
|
基礎毒性試驗 |
13.63 % |
>100 % |
|
pH 6 |
11.50 % |
>100 % |
|
pH 7 |
11.08 % |
>100 % |
|
pH 8 |
14.14 % |
>100 % |
|
pH 9 |
17.00 % |
>100 % |
|
曝氣 |
14.10 % |
>100 % |
|
過濾 |
11.63 % |
>100 % |
|
沸石吸附 |
>100 % |
>100 % |
|
添加硫代硫酸鈉 |
12.41 % |
>100 % |
|
C-18固相萃取 |
10.33 % |
>100 % |
|
陽離子樹脂 |
>100 % |
>100 % |
- S1-1放流水樣對羅漢魚之幼魚不具有毒性,但對於D. magna水蚤而言卻是劇毒(48hr-LC50為10.34%,TUa=9.67),顯示S1- 1放流水對於水中無脊椎生物而言有較大傷害性。
- 在梯度調整pH試驗中發現隨著pH的增高,放流水樣對D. magna水蚤的毒性沒有明顯增加,反而有些微的減低,這個試驗結果可以判定水樣的毒性不會來自於氨氮,因為若放流水中氨氮濃度偏高時,會隨著pH的增高而增加自由氨的濃度,因而大大提高水樣的毒性。
- 經由曝氣試驗結果發現毒性沒有有效的去除,因此判定水樣的毒性應該不是來自於揮發性或易氧化性的化合物。
- 經由過濾試驗結果發現毒性沒有減少,因此判定水樣的毒性不是來自於懸浮微粒固體。
- 在氧化物質還原試驗中添加硫代硫酸鈉於水樣,發現毒性沒有減低,因此判定水樣的毒性不是來自於氧化性化合物如過氧化氫和次氯酸鈉。
- 在碳18固相萃取試驗中,發現毒性沒有減少,因此判定水樣的毒性不是來自於非極性化學物質。
- 在沸石吸附與陽離子交換樹脂吸附試驗中,發現毒性可以完全去除,因此可初步判定S1-1放流水樣對D. magna水蚤的毒性應來自於金屬陽離子。
S1-2放流口經不同物化處理後之毒性特性試驗結果如 表7所示。
|
測試項目 |
Daphnia magna 48hr-LC50(%) |
Pseudorasbora parva 96hr-LC50(%) |
|---|---|---|
|
原水樣 |
38.89 |
>100 |
|
基礎放流水毒性 |
39.54 |
>100 |
|
pH 6 |
40.16 |
>100 |
|
pH 7 |
40.36 |
>100 |
|
pH 8 |
42.78 |
>100 |
|
pH 9 |
43.87 |
>100 |
|
曝氣 |
37.48 |
>100 |
|
過濾 |
55.71 |
>100 |
|
沸石吸附 |
53.89 |
>100 |
|
添加硫代硫酸鈉 |
42.93 |
>100 |
|
C-18固相萃取 |
41.71 |
>100 |
|
陽離子樹脂 |
>100 |
>100 |
- S1-2放流水樣對羅漢魚之幼魚不具有毒性,但對於D. magna水蚤卻有毒性(48hr-LC50為38.89 %, TUa=2.57)。
- 在梯度調整pH試驗中,發現隨著pH的增高,放流水樣對D. magna水蚤的毒性沒有明顯增加,反而有些微的減低,這個試驗結果可以判定水樣的毒性不會來自於氨氮,因為若放流水中氨氮濃度偏高時,會隨著pH的增高而增加自由氨的濃度,因而大大提高水樣的毒性。
- 經由曝氣試驗結果,發現毒性沒有有效的去除,因此判定水樣的毒性應該不是來自於揮發性或易氧化性的化合物。
- 經由過濾試驗結果,發現毒性沒有明顯減少,因此判定水樣的毒性不是來自於懸浮微粒固體。
- 氧化物質還原試驗中,添加硫代硫酸鈉於水樣,發現毒性沒有減低,因此判定水樣的毒性不是來自於氧化性化合物如過氧化氫和次氯酸鈉。
- 碳18固相萃取試驗中,發現毒性沒有減少,因此判定水樣的毒性不是來自於非極性有機化合物。
- 沸石吸附試驗中,發現毒性沒有減少,因此判定水樣的毒性不是來自於氨氮。
- 陽離子樹脂吸附試驗中,發現毒性可以完全去除,因此初步判定S1-2放流水對D. magna水蚤的毒性應來自於金屬陽離子。
S1-3放流口經不同物化處理後之毒性特性試驗結果如 表8所示。
|
測試項目 |
Daphnia magna 48hr-LC50(%) |
Pseudorasbora parva 96hr-LC50(%) |
|---|---|---|
|
初始毒物試驗 |
2.69 |
15.00 |
|
基礎毒性試驗 |
3.23 |
16.80 |
|
pH 6 |
3.56 |
16.10 |
|
pH 7 |
3.45 |
16.65 |
|
pH 8 |
2.97 |
18.50 |
|
pH 9 |
2.25 |
20.78 |
|
曝氣 |
41.60 |
44.98 |
|
過濾 |
32.94 |
35.23 |
|
沸石吸附 |
40.17 |
50.38 |
|
添加硫代硫酸鈉 |
89.28 |
63.47 |
|
C-18固相萃取 |
3.38 |
18.60 |
|
陽離子樹脂 |
34.30 |
35.23 |
經由實驗結果,發現下列現象:
- S1-3放流水樣不論對D. magna水蚤或羅漢魚皆具有急毒性, D. magna水蚤之48hr-LC50為2.69% (TUa=37.17)、羅漢魚幼魚之96hr-LC50為15.00% (TUa= 6.67),顯示毒性非常高。
- 梯度調整pH試驗結果,發現隨著pH的增高,放流水樣對D. magna水蚤的毒性有稍微增加,推測是放流水中的氨氮隨著pH的增高,因而增加自由氨的濃度,根據實驗室先前的實驗結果,發現氨氮在pH=8時對D. magna水蚤之48hr-LC50為39.62mg/L,而S1-3水樣中,檢測到氨氮的濃度為41.4mg/L,因此判斷氨氮貢獻水樣中部分的毒性來源。但羅漢魚幼魚的生物毒性測試,則沒有觀察到此現象,推測原因可能是羅漢魚對氨氮濃度的耐受度稍微高些(羅漢魚的96hr-LC50為51.44mg/L),水樣中的氨氮濃度尚不至於造成魚隻的死亡。
- 曝氣試驗結果,發現毒性明顯減少,顯示水樣的毒性應該部份來自於揮發性或易氧化性的化合物。
- 過濾試驗結果,發現毒性明顯降低,但由於實驗室採用真空吸氣過濾方式,因此在判斷毒性來源時,需與曝氣試驗結果相比對,再來判斷毒性是否由懸浮微粒、揮發性物質或是易氧化性的化合物所引起。
- 氧化物質還原試驗,添加硫代硫酸鈉於水樣,發現毒性大幅被去除,因此判定水樣的毒性應是來自過氧化氫(水樣過氧化氫濃度高達210 mg/L)。
- 碳18固相萃取試驗,發現毒性沒有減少,因此判定水樣的毒性不是來自於非極性化學物質。
- 沸石吸附與陽離子交換樹脂吸附試驗,發現毒性皆有明顯減少,因此判定水樣的毒性,除了氨氮之外,有部分來自於金屬陽離子。
研究完成目標分析物之參考毒物試驗,確認過氧化氫、次氯酸鈉、二價銅離子、非氧化性殺菌劑與酵素對D. magna水蚤及羅漢魚之毒性大小,從高至低依序為:二價銅離子>次氯酸鈉>過氧化氫>非氧化性殺菌劑>酵素,參考毒物之LC50如 表9 所示。
|
參考毒物 |
Daphnia magna 48hr-LC50 (mg/L) |
Pseudorasbora parva 96hr-LC50 (mg/L) |
|---|---|---|
|
H2O2 |
3.71 |
34.90 |
|
NaClO |
0.14 |
0.70 |
|
CuSO4 |
0.089 |
0.22 |
|
酵素 |
14941 |
7743 |
|
非氧化性殺菌劑 |
5.12 |
10.33 |
採集原始放流水樣,以環保署公告之標準方法D. magna水蚤及羅漢魚靜水式法,測試其生物急毒性之LC50,其檢測結果如 表10所示。
|
放流口採樣點 |
Daphnia magna 48hr-LC50 |
Pseudorasbora parva 96hr-LC50 |
|---|---|---|
|
S1-1 |
10.34 % |
>100 % |
|
S1-2 |
38.89 % |
>100 % |
|
S1-3 |
2.69 % |
15.00 % |
綜合上述發現 S1-3水樣水體毒性較強,顯示製程廢水若不經添加酵素處理,其放流水對自然水體環境生物衝擊甚大極具毒性。以毒性鑑定評估三個水樣的毒性分別表徵在:
- S1-1:重金屬
- S1-2:鹽度、重金屬
- S1-3:鹽度、重金屬、氨氮及過氧化氫
S1-3樣經去除毒性,添加過氧化氫與次氯酸鈉後,實驗結果顯示對D. magna水蚤而言,廠定過氧化氫目標10mg/L及次氯酸鈉0.2mg/L,皆無法符合放流水之生物毒性標準。對羅漢魚而言,由於其對過氧化氫與次氯酸鈉耐受度較高(96hr-LC50分別為34.90、0.70mg/L),所以不受影響。
S1-2水樣經添加二價銅離子後去除毒性,,實驗結果顯示若將硫酸銅添至廠定目標濃度 (0.20mg/L)時,發現D. magna水蚤和羅漢魚幼魚的LC50均大於100%,顯示無明顯毒性,但此結果是在水硬度較高時的結果。
S1-3水樣經添加酵素後去除毒性,實驗結果顯示若將酵素添至廠定目標濃度(30mg/L)時,發現D. magna水蚤和羅漢魚LC50均大於100%,顯示廠定添加目標濃度可以符合水質生物毒性標準。
線上驗證
依據清華大學之放流水毒性鑑定結果,我們針對 S1-3 放流口執行系統改善,我們先選定廠內目前較具毒性,且以系統現況可改善之NaOCl 與雙氧水兩個項目,於廠內調整其最佳之放流濃度範圍,將NaOCl與雙氧水降至目標值如 表11,再執行放流水之生物急毒檢測,藉以驗證廢水減毒之功效,此部分委由檢測公司依環檢所公告之檢測方法如 表12執行放流水之生物急毒檢測。
|
生物毒性物質 |
Target |
改善對策 |
|---|---|---|
|
過氧化氫(H2O2) |
<4 mg/l |
添加過氧化氫酶酵素,降低放流水中H2O2濃度 |
|
NaOCl |
自由餘氯<0.15 mg/l、餘氯<0.7 mg/l |
減少NaOCl加藥量,調整回收系統與RCW加藥之最佳化 |
|
編號 |
方法名稱 |
測試物種 |
物種照片 |
測試時間 |
公告日期 |
|---|---|---|---|---|---|
|
NIEA B901.148 |
水蚤 靜水式法 |
水蚤(Daphnia) Daphnia pulex或Daphnia magna |
|
48 hr |
102/08/13 |
|
NIEA B902.138 |
羅漢魚 靜水式法 |
羅漢魚 (Pseudorasbora parva) |
|
96 hr |
102/08/13 |
|
NIEA B903.138 |
粗首鰓 靜水式法 |
粗首鰓 (Opsariichthys pachycephalus) |
|
96 hr |
102/08/13 |
|
NIEA B904.138 |
鯉魚 靜水式法 |
鯉魚 (Cyprinus carpio) |
|
96 hr |
102/08/13 |
|
NIEA B905.138 |
米蝦 靜水式法 |
多齒新米蝦 (Neocaridina denticulate) |
|
48 hr |
102/08/13 |
|
NIEA B908.108 |
廣鹽性青鱂魚 靜水式法 |
廣鹽性之青鱂魚 (Medaka, Oryzias latipes) |
|
96 hr |
104/01/22 |
所得之放流水生物急毒性數據由 表13顯示,前1~3次為對照組為尚未對系統調整加藥時之生物急毒性檢測,非脊椎與脊椎生物其TUa皆無法低於<1.43,於第四次實驗前,開始調整系統之過氧化氫與NaOCl (自由餘氯與結合餘氯)加藥量,有效控制放流水之濃度低於目標值,第4~6次實驗為加藥調整後之生物急毒性檢測數據,其檢測結果明顯在脊椎生物(鯉魚)測試方面可符合TUa<1.43之標準,但於非脊椎生物(水蚤)方面無法符合標準,由先前之TIE 毒性鑑定S1-3所含之毒性尚有鹽度與重金屬(Cu2+)毒性,因廠內廢水處理系統尚無法有效處理上述物質至非脊椎生物之目標,故若非脊椎生物TUa要穩定小於1.43,需另外針對導電度與重金屬(Cu2+)設置處理系統。
|
Target (TUa) |
採樣位置 |
S1-3 |
|||||
|---|---|---|---|---|---|---|---|
|
次數 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
< 1.43 |
非脊椎 (水蚤) |
> 5 |
> 5 |
> 5 |
> 5 |
> 5 |
> 5 |
|
< 1.43 |
脊椎 (鯉魚) |
> 5 |
> 5 |
> 5 |
< 1 |
< 1 |
< 1 |
結論
目前廠內依照上述廢水毒性減量執行成果,由原先兩種生物 TUa 皆大於5,執行減毒過後,脊椎生物小於1,初步已達第一目標。惟放流水之重金屬濃度尚屬偏高,若須穩定達成非脊椎生物 TUa<1.43,勢必持續降低放流中之導電度與重金屬濃度。
此外,依據TIE 毒物特性試驗及毒性鑑定分析結果,判斷放流口水樣的毒性來源主要來自於過氧化氫、NaOCl(自由餘氯與結合餘氯)、金屬銅離子、鹽度及氨氮。添加酵素(廠定目標濃度30 mg/L)可有效分解過氧化氫,但會在放流水中產生過飽和氧,對水生生物的毒性反而增加,因此建議添加酵素後的放流水需增加曝氣或攪動方式,讓水中過飽和氧逸散消失。
參考文獻
- US EPA, Methods for Aquatic Toxicity Identification Evaluations: Phase I Toxicity Characterization Procedures. Second Edition. EPA-600-R-91-003, 02/01/1991.
- US EPA, Methods for Aquatic Toxicity Identification Evaluations: Phase II Toxicity Identification Procedures for Samples Exhibiting Acute and Chronic Toxicity. EPA-600-R-92-080, 09/01/1993.
- US EPA, Methods for Aquatic Toxicity Identification Evaluations: Phase III Toxicity
- EPA-600/3-88/034,1988
- 行政院環境保護署,高科技產業放流水中生物毒性成因之探討(1/4)專案研究計畫期末報告,EPA-102-E3S5-02-01,2013。
- 行政院環境保護署,高科技產業放流水中生物毒性成因之探討(2/4)專案研究計畫期末報告,EPA-102-E3S5-02-02,2014。
- 凌永健,高科技產業放流水中生物毒性成因之探討(1/4)專案研究計畫,行政院環境保護署環境檢驗所委託研究,2013。
- 環境保護署,「高科技產業廢水水質特性分析及管制標準探討計畫」期末報告,2007。
- 環境保護署,「產業廢水污染調查及管制措施研議計畫(第一~三年)」期末報告,2009~2011。
- 台灣半導體產業協會,2011年。









留言(0)