摘要

腐蝕性特殊氣體(特氣)為半導體產業中常見的化學品,其在更換特氣元件的過程易與空氣中水氣產生酸性的腐蝕化合物,造成人體或設備元件有接觸腐蝕及不純物汙染的風險。本研究以更換氯氣(Cl2)氣體分配箱(valve Manifold Box, VMB)內的調壓閥為例,探討更換腐蝕性特氣元件時的環境濕度與腐蝕性汙染物生成的關係,計算出環境濕度需於10%以下,並在10分鐘內完成更換方能避免更換過程形成的腐蝕性不純物濃度高於Certification of Analysis(CoA)所標示之不純物濃度。在實際更換調壓閥前,先以混合氣(O2/N2)吹入通風罩(Cover)中降低環境濕度後,於10分鐘內完成調壓閥更換,同時以有毒氣體偵測器(TLD-1)確認更換過程中無氯氣及含氯化合物的讀值。本研究可應用於腐蝕性特氣元件的更換,作為廠務端於特氣元件更換的安全及汙染風險控管的參考案例。
Corrosive special gas is commonly used chemicals in semiconductor industry, and it would react with moisture to make corrosive acidic compound during the replacement of parts. In this research, we take the replacement of the regulator in chlorine VMB for example and investigate the relationship between ambient humidity and the production of corrosive pollutants. According to the theory, the concentration of corrosive impurities would be higher than the impurities concentration labeled on the COA while replacing parts within 10 minutes in case the ambient humidity is below 10%. In the experiment, the mixed gas was channeled into the cover to decrease ambient humidity before replacing regulators, and make sure the replacement was finished within 10 minutes. The concentration of chlorine and chloring-containing compounds was detected by TLD-1 throughout the process. This research provides the profound insight for the safety and containment risk control for replacing parts of corrosive special gas.
1. 前言
在半導體產業中,特殊氣體扮演生產過程的重要角色,以因應製程的不同需求。特殊氣體可依其化學性質分為腐蝕性、可燃性、助燃性、毒性、惰性氣體等,其中腐蝕性氣體因其化學結構特性,易與水分接觸後水解產生HCl或HF等酸性腐蝕性化合物,而對於設備中的管路閥件或人體的皮膚及呼吸系統造成腐蝕作用,常見的腐蝕性氣體可分為下列 :
- 氯系 : HCl、Cl2、BCl3、SiH2Cl2、SiCl4
- 氟系 : F2、BF3、ClF3、NF3、WF6、SiF4
- 溴系 : HBr
- 其他 : NH3、N2O
在200mm廠區,因廠務系統運轉時間長,特氣元件因使用年限因素而待需更換。腐蝕性特氣元件在更換過程時,管件內的殘留氣體會曝露於空氣中而與空氣中的水分反應產生腐蝕性化合物,造成更換人員有接觸或吸入腐蝕性氣體之風險外,並有腐蝕管件內部之金屬元件造成內部汙染之虞。
Fab5因應特氣VMB調壓閥更換有上述風險,除了在加裝抽氣的cover內作業外,且引進混合氣purge,避免更換管路內殘留氣體逸散至環境外,更能降低cover內空氣含水量抑制腐蝕性化合物生成。
2. 文獻探討
2.1 腐蝕性氣體特性
特殊氣體當中的腐蝕性氣體在純氣的狀態下是不具直接腐蝕性,如含鹵素族的腐蝕性氣體以式1為例,其與水氣接觸反應後會解離產生腐蝕性產物,然而目前針對臨界水氣含量的相關文獻仍為數不多。
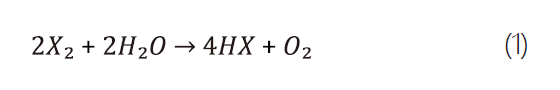
其中,X=halogen element。
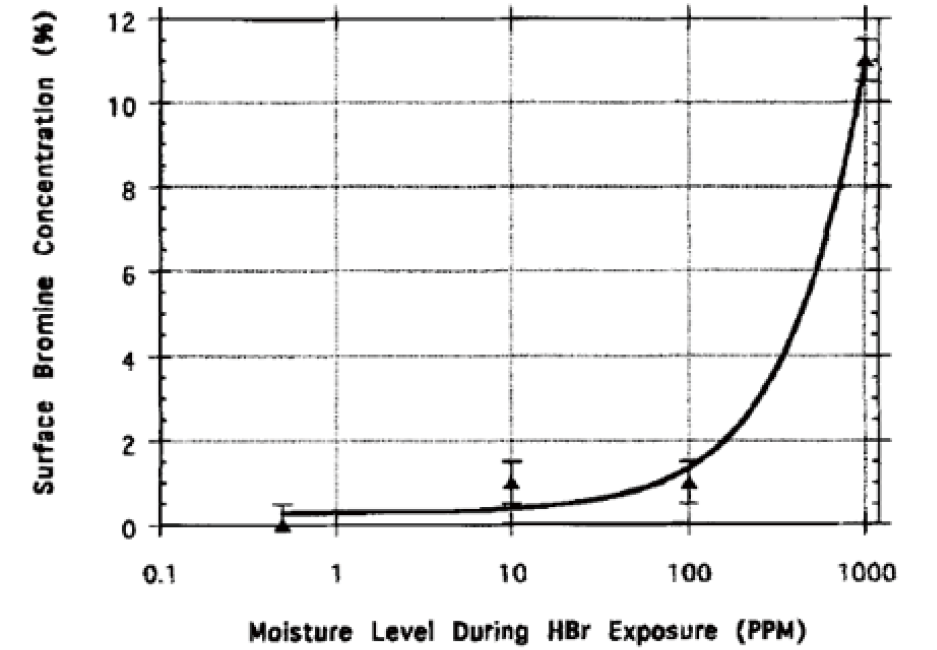
腐蝕性氣體所造成的腐蝕作用於一般操作條件中雖為一個緩慢進程,但長期仍會造成管路閥件的表面缺陷及汙染,其中尤以焊道處及受熱區域特別容易腐蝕。圖1說明HBr氣體含水量在0.5、10、100ppm時,HBr對不鏽鋼材料的腐蝕情形,說明含水量在10ppm以上時開始腐蝕不銹鋼材料,在大於100ppm後腐蝕速率明顯增快。[1]
圖1、不鏽鋼材料在不同含水量HBr曝露情況下的表面含Br量
另腐蝕性氣體常有黏滯性高的特點,因此需要以N2 purge來減少該類腐蝕性氣體的化合物殘留於管路。但一般purge用N2氣體多為常溫20~25℃,對於HBr、HCl、Cl2等黏滯性較高的氣體的purge效果較差,而造成殘存液滴與水氣反應。
目前針對該如何有效控制腐蝕性氣體的運輸,為當前操作腐蝕性氣體元件的重要課題,主要解決方法如下 : [2][3]
- 使用抗腐蝕性強的物質如Hastelloy閥
- 使用表面拋光處理良好,粗糙度低的管件,降低表面黏滯的風險
- 降低鋼瓶或管路閥件的更換頻率,降低暴露於大氣的機會
- 操作時增加N2 Purge次數,同時N2前加裝purifier降低水分含量
- 提升供應溫度,降低氣體的黏滯性
2.2 氯氣特性
本研究中,選擇氯氣作為實驗對象,因其在半導體業中使用廣泛外,且對氯氣性質的相關研究完整。在室溫中,氯氣為一種氧化性氣體且可迅速溶於水中並水解產生次氯酸(HOCl)及鹽酸(HCl),其正逆反應式如式2、式3。[4]
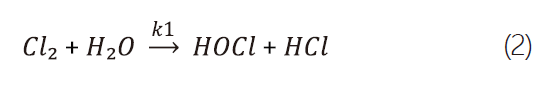
其中,k1=61.7s-1 @37℃。
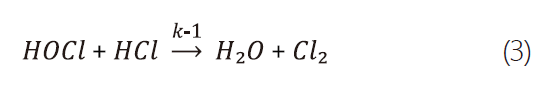
其中,k-1=3.46*10-2 M-2 s-1 @37℃。
在不考慮化學反應的情形下,氣體溶於水中的速率是由氣液介面間的擴散、質量適應(mass accommodation)及根據水中飽和度而定。在考慮氯氣由氣相中溶於一半無限(semi-infinite)的液相中且不產生化學反應,則其在時間t內的溶解量可由式4表示 : [5]
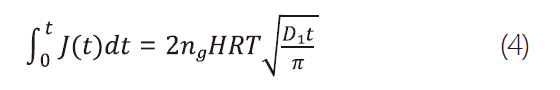
其中,J=flux of molecules from the gas phase to the liquid phase;ng=density of trace gas;R=gas constant(0.082 dm3atmK-1mol-1);D1=liquid-phase diffusion coefficient of the trace gas(cm2s-1);H=Henry's law coefficient(Matm-1);T=temperature(K)。
但實際上,由於氯氣溶於水中後會迅速再水解並抵銷飽和效應,Dankwerts提出以enhancement factor(E)來闡述在有化學反應下的溶解量及單純考慮亨利定律下的溶解量的比例,其可以用式5表示 : [6]
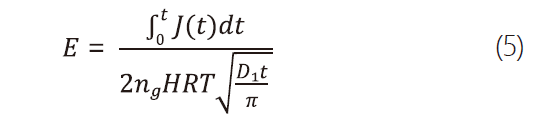
對氯氣而言,其溶於水中及後續相關水解反應如下式 : [5]
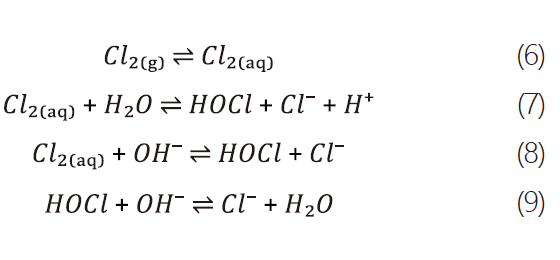
在近中性的環境下(pH≈7),因近表層(near-surface)的羥基(OH-)很快就耗盡使式8、式9的反應速率降低,同時式7的逆反應也可忽略,整體反應由式7主導,並使近表層的液相酸化,而E也可表示為式10。
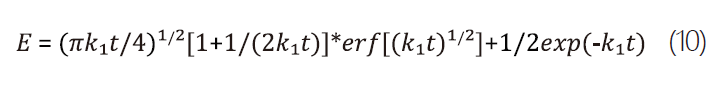
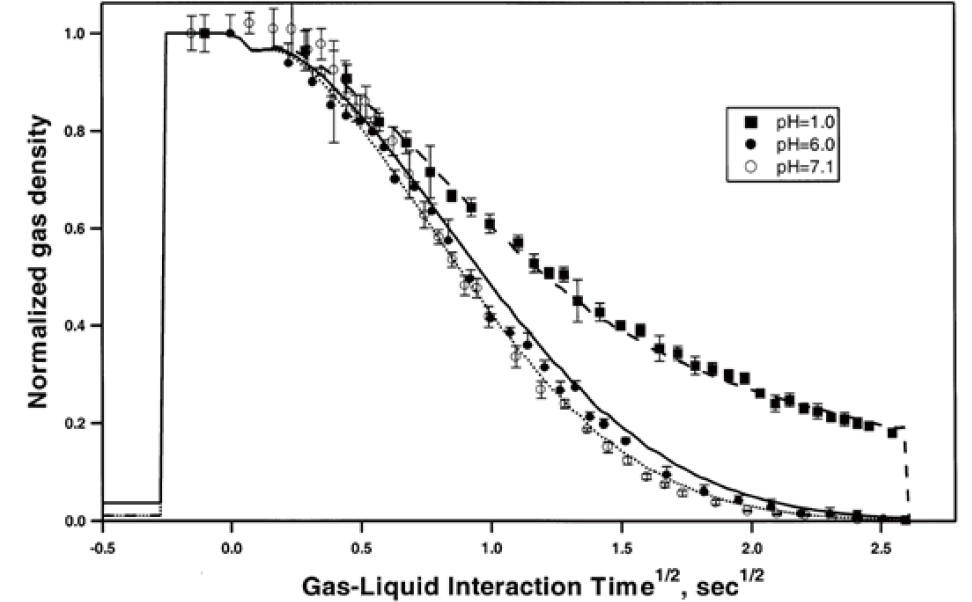
同時,在不同初始的pH的情況下,氯氣的耗用量如 圖2,其中y軸為經過反應時間t後,在氣象中的標準化(normalized)氯氣密度。M.Gersgenzon等人計算出在pH<5.5([H+]=3*10-6M)的環境下,初始[H+]濃度影響可忽略。若要達到pH<5.5,僅考慮Cl2(aq)由式8、式9轉換為H+的情況下,其所需時間τ可由式10計算而得約只要0.15s,但相較於整體反應時間可忽略不計。由此可知在pH6.0或7.1的條件下,氯氣溶於水中反應的過程中由氯氣的水解反應主導。[5]
圖2、標準化氯氣密度-氣液界面反應時間的方均根圖 (T=293K,--- : 非反應性溶解;••• : 由式7主導的反應性溶解)
3. 研究方法
3.1 腐蝕性化合物生成
由於F5的特殊氣體的供應管路閥件使用時間長(>15 year),部分閥件已有腐蝕內漏的情形。本次研究選擇氯氣作為研究對象,針對其VMB內已有內漏現象的調壓閥進行更換。
在更換當下空氣中的水氣為近中性的條件下,氯氣的水解反應在氯氣溶解及後續水解的過程中為主導反應。由式2,我們可以推得式11,同時假設在更換過程中空氣中的水氣含量恆定,則可進一步推得氯氣及氯化氫濃度分別為式12、式13。

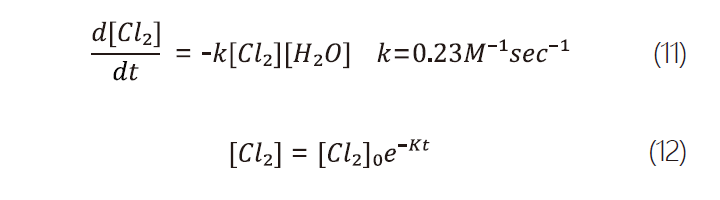

其中,K=k[H2O]。
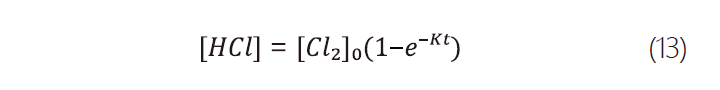
在更換前需先將該支使用端(stick)由設備端以真空泵浦抽負壓至殘壓<0.01torr使得開始拆卸閥件,已避免殘氣量過多而造成人員安全疑慮。若以殘壓0.01torr,拆卸下的管路體積1cm3,環境溫度(22℃)的條件下,根據理想氣體方程式(式14)可計算得該段管路內的初始氯氣濃度[Cl2]0為5.43*10-7M。

其中,P=pressure(Pa);C=gas concentration(mol/m3);R=ideal gas constant(8.314Pa*m3/(mol*K));T=temperature(K)。
因更換地點位於sub-fab,設其環境條件與fab相同(壓力1atm,溫度22℃,相對溼度=45%),根據 表1可得水氣濃度[H2O]為5*10-3M。
|
溫度(℃) |
最高溼度(g/m3) |
相對溼度(%) |
相對溼度(g/m3) |
水氣濃度(M) |
|---|---|---|---|---|
|
22 |
20 |
45 |
9 |
0.00050 |
|
40 |
8 |
0.00044 |
||
|
35 |
7 |
0.00039 |
||
|
30 |
6 |
0.00033 |
||
|
25 |
5 |
0.00028 |
||
|
20 |
4 |
0.00022 |
||
|
15 |
3 |
0.00017 |
||
|
10 |
2 |
0.00011 |
||
|
5 |
1 |
0.00006 |
||
|
1 |
0 |
0.00000 |
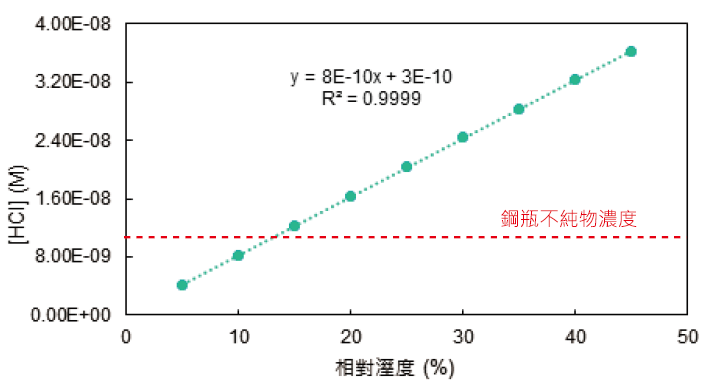
氯氣鋼瓶含供應管路約50L,鋼瓶內淨重41kg,並參照CoA中不純物≦1ppb的規格下。因HCl溶液相較於HClO溶液,對管路閥件及人體的危害較大,因此假設原鋼瓶內的不純物為氯化氫(HCl)組成,則其不純物濃度為1.16*10-8M。假設調壓閥的更換過程所需時間t為10min,則根據式13及上述條件計算可得在不同的相對濕度下,氯氣水解產生的HCl濃度[HCl]如圖3。若要使更換過程所生成的HCl濃度小於不純物HCl濃度(紅線),則需將環境的相對濕度控制在14.1%以下。
圖3、HCl生成濃度-相對溼度關係圖
3.2 施工硬體配置
本次研究設置一小型外掛壓克力通風罩(cover)罩於VMB外,同時通入混合氣進cover內並設置排氣孔以進行換氣循環,簡圖及現場架設圖如 圖4所示。更換前,會先以在cover內的溼度計確認相對濕度已在10%以下,方可開始更換。
圖4ⓐ、VMB cover示意圖
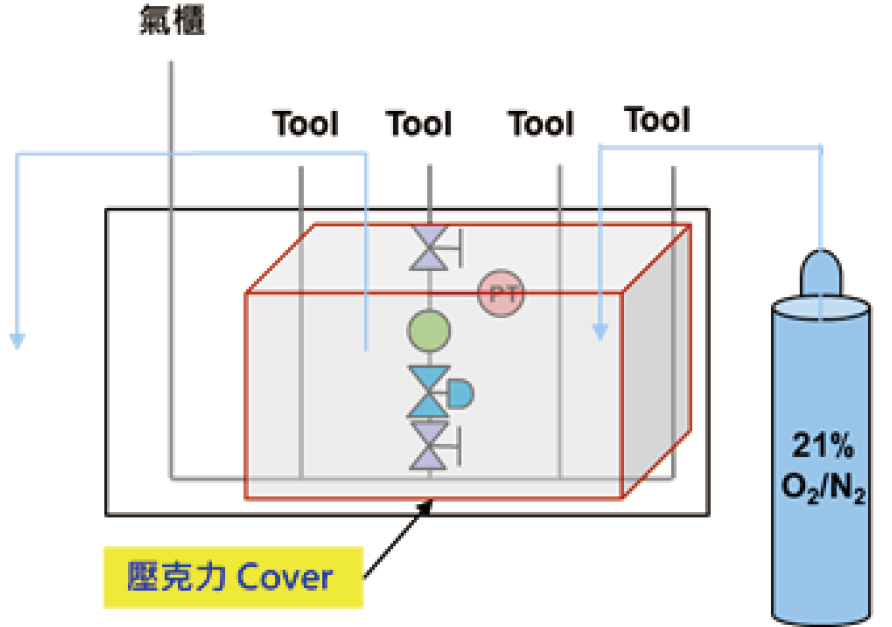
圖4ⓑ、VMB cover側視圖
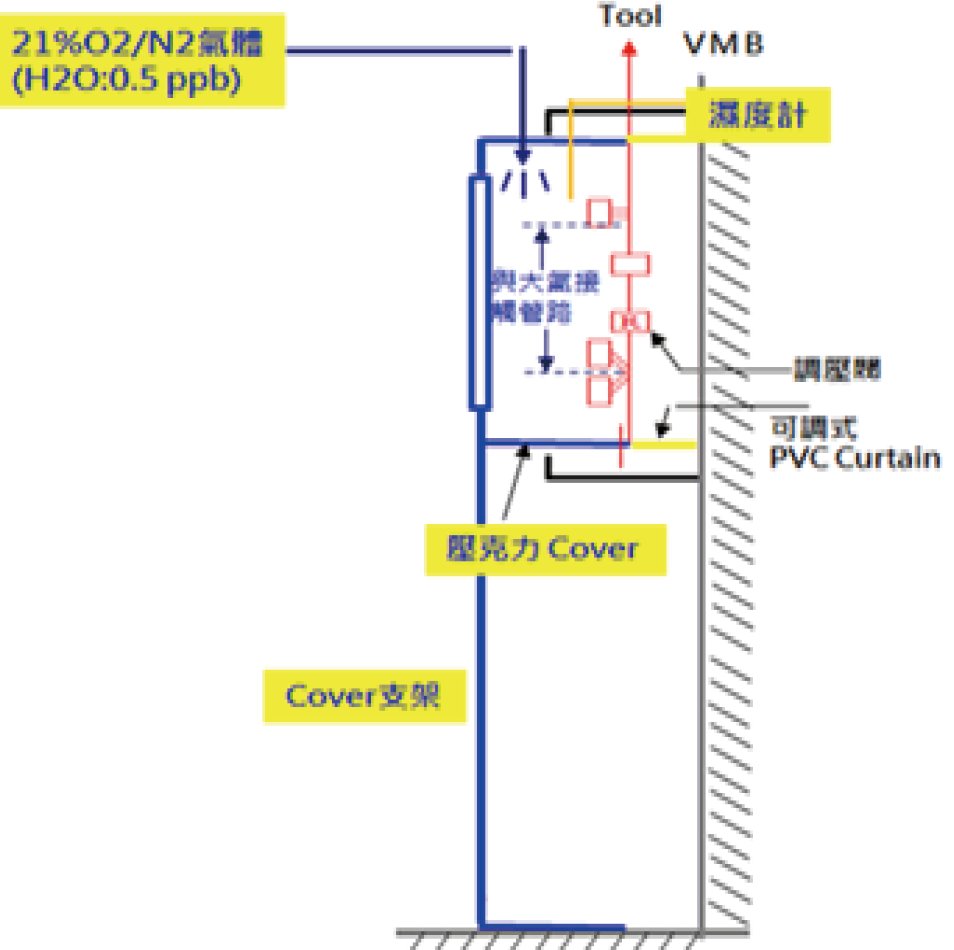
圖4ⓒ、VMB cover現場架設圖

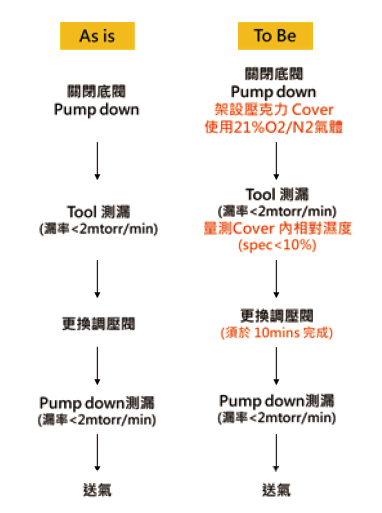
此次調壓閥更換手法相較於過往,主要精進了環境濕度的控制及限制更換時間(如 圖5),以避免閥件腐蝕與管路二次汙染的可能。
圖5、VMB閥件更換精進程序
4. 結果分析
4.1 環境濕度控制及異常濃度檢測
混合氣的含水量為0.5ppb,水氣濃度(2.78*10-8M)相較於環境中含水量可忽略。在混合氣出口壓調為2kg/cm2的情形下,在此次前置作業時可在1分鐘內達成相對溼度<10%的目標(如 圖6)。同時在更換過程中(更換時間 : 461sec) ,氯氣偵測器讀值也都為0,確保無殘留氯氣或水解產生之含氯化合物。
圖6、現場溼度計讀值

4.2 設備機台檢測
本次研究搭配設備機台(AMET-B)PM停機更換,在更換完成後針對顆粒(particle, PA)、蝕刻速率(Etch rate, E/R)及蝕刻均勻度Etch rate uniformity, E/R uniformity進行monitor,確認更換前後品質相符(圖7),也驗證此PM精進手法的實際應用性。
圖7ⓐ、PA count
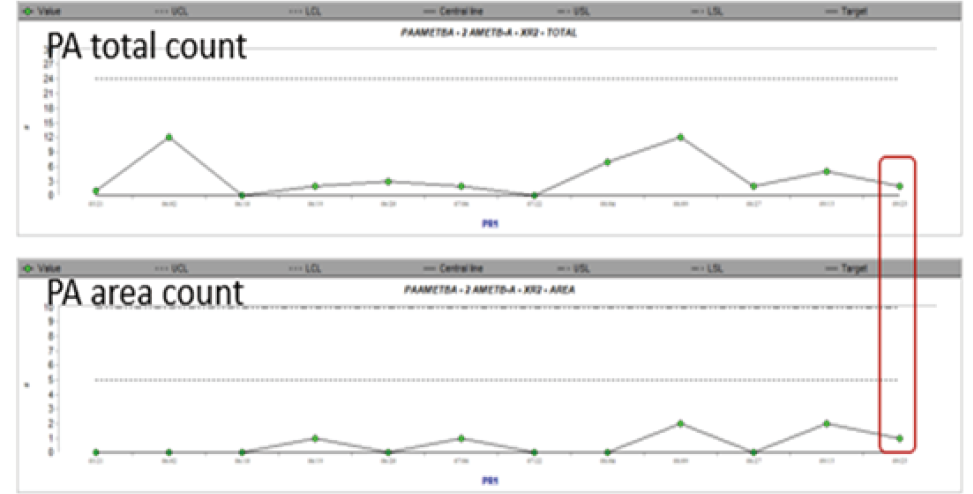
圖7ⓑ、E/R & E/R uniformity
5. 結論
本次研究以氯氣為研究對象,針對特氣元件更換過程中的實際條件,計算出所需控制的環境濕度,並成功在實際更換過程中驗證此手法精進的可行性。此更換手法除了能減少HCl的形成,降低特氣元件被腐蝕及形成二次汙染的情形,同時也減少操作人員接觸腐蝕性氣體的風險。
參考文獻
- S. M. Fine, et al., The role of moisture in the corrosion of HBr gas distribution system, J. Electrochem. Soc, 1995.
- P. L. T. Brian, et al., The effect of temperature on the rate of absorption of chlorine into water, Chem. Eng. Sci., 1966.
- G. L. Squadrito, et al., Elucidating mechanisms of chlorine toxicity reaction kinetics, thermodynamics, and physiological implications, Am. J. Physiol. Lung Cell Mol. Physiol., 2010.
- C. W. Spalding, Reaction kinetics in the absorption of chlorine into aqueous media, AIChE J, 1962.
- M. Gershezon, et al., Rate constant for the reaction of Cl2(aq) with OH-, J. Phys. Chem. A, 2002.
- Danckwerts, P. V. Gas-Liquid Reactions, Chemical Engineering Series; McGraw-Hill; New York, 1970.

留言(0)