摘要

先進半導體硫酸鈷廢水特性與處理技術探討
Keywords / Advanced Semiconductor Process,Cobalt Sulfate Wastewater,Ion Exchange Resin
前言
金屬鈷廢水為先進半導體製程新議題,主要來源為ECP(Co)與CMP (Co)製程所排放,金屬鈷處理方法可分為物理性吸附,化學氧化還原,電化學方式等,由於鈷金屬放流濃度為ppb,此廢水處理考驗前所未有參考文獻鮮少,故為先進半導體製程首次面對的嚴峻考驗,需面對問題包含,硫酸鈷廢水特性,廢水的來源與質量平衡調查,處理方法選擇,處理單元效率,廢棄物去化等問題即需釐清與制定,本篇文章將探討2019先進半導體廠區運轉相關經驗與測試結果分析作為未來先進廠區設計及運轉之參考。
文獻探討
依據先進半導體廠區鈷廢水排放要求,將進行鈷廢水處理方法選擇與評估文獻探討,技術評估要求如下:首要條件需達到Co濃度達ppb等級、避免衍生二次污染物(相轉換)、資源化(符合未來廠內規劃電鍍鈷棒)為首要目標。現行鈷廢水處理方式區分為離子交換樹酯法、化學混凝沉澱法、吸附法、薄膜法與電化學法,原理與技術如下所述。
離子交換法
離子交換(ion exchange)是利用固體物質表面藉由靜電力維繫之官能基與溶液中相同電荷之離子交換,帶電荷之離子被自溶液中除去,同時有相同當量之同種電荷之離子(來自被置換之官能基)被釋回溶液中。離子交換通 常被用在去除或交換溶解狀的無機鹽類如淨水軟化及重金屬之去除。離子交換是可逆的相互離子交換反應,即不溶解的樹脂顆粒可從電解質水溶液中,將正電荷或負電荷的離子去除,同時將等當量的相同電荷之其它離子釋入水溶液中,而此種反應的發生並不會改變樹脂本身的結構。利用此特性可以當樹酯吸附飽和後利用再生液再生,並可將高濃度再生液回收或資源化(Werner Stumm)。
化學沉澱法
化學沉澱法是指向重金屬廢水中投放藥劑,通過化學反應使溶解狀態的重金屬生成沉澱而去除的方法。包括中和沉澱法、硫化物沉澱法、鋇鹽沉澱法等。中和沉澱法應用比較廣泛,向重金屬廢水中投放藥劑(如石灰石)使廢水中重金屬形成沉澱而去除。化學沉澱法處理重金屬廢水具有工藝簡單、去除範圍廣、經濟實用等特點,是目前應用最為廣泛的處理重金屬廢水的方法,其缺點為產生大量污泥需考量去化問題[1][2]。
吸附法
藉由吸附劑本身之高比表面積及多孔性特質,透過凡德瓦爾力、錯合或靜電吸引等機制,與重金屬離子產生物理吸附行為。重金屬離子於水相-固相吸附劑吸附擴散之行為,當重金屬濃度膜外層比內層大時,溶液中重金屬離子先由擴散通過固體吸附劑邊界層,再擴散至吸附劑表面上,最後會進入孔洞內,因此吸附劑表面積與孔洞數量越多,其吸附能力越強,此法受限於吸附劑對於重金屬專一性,且吸附後基材脫附與資源化受限問題[3] 。
薄膜法
薄膜分離技術是利用不同成分透薄薄膜速率上的差異來進行分離,而物質透過膜的驅動力可以是濃度差、電位差、溫度差、或是壓力差。常見以濃度差為驅動力的薄膜分離程序是透析,以電位差為驅動力的薄膜分離程序是電透析,以溫度差為驅動力的程序是薄膜蒸餾。而常見以壓力差為驅動力的薄膜分離程序則有微過濾(Microfiltration, MF)、超過濾(Ultrafiltration, UF)、奈米過濾(Nanofiltration, NF)、逆滲透(Reverse Osmosis, RO)、氣體分離(Gas Separation)、及滲透蒸發(Pervaporation)。常用於廢水處理的薄膜分離技術,其驅動力多屬於壓力差。其中微過濾、超過濾、奈米過濾及逆滲透是以膜孔大小,或所能阻擋粒子之大小來區分。MF膜孔在0.05~10μm,UF膜孔為1~100nm之間,所能阻擋粒子的分子量約為1,000至500,000 Daltons。RO薄膜的孔徑小於1nm,可以阻擋如Na+,Cl-等一價離子的透過。NF的膜孔則介於RO及UF之間,可以阻擋分子量在200至1,000 Daltons間之粒子,其對一價離子的阻擋率不高,但可阻擋二價離子。至於滲透蒸發程序使用的薄膜則十分緻密,足以讓有機溶劑與水的透膜速率不同,常被用來分離有機溶劑與水的混合溶液。一般而言,去除水中的細菌或懸浮粒子,可以採用MF。若要去除病毒、蛋白質等膠體粒子,或是染料、高分子等有機物,常採用UF。要去除所有的離子,需用RO。但若只需去除二價以上的離子,或分子量數百的分子,可以採用NF。而如果要移除水中的揮發性有機物,則應考慮採用滲透蒸發程序。此法將重金屬分離並濃縮,但受限於適用於低濃度重金屬,高濃度重金屬容易造成嚴重膜阻塞[4]。
電化學法
電化學法是應用電解的基本原理,使廢水中重金屬離子在陽極和陰極上分別發生氧化還原反應,使重金屬富集,將廢水中重金屬電解或形成污泥將金屬去除,電化學法分為:電凝聚法、磁電解法、電滲析法、電還原法、內電解法、電子去離子技術(Electrodeionization, EDI)等,電化學法耗能且重金屬效率受限於電極轉化效率,容易產生大量污泥造成去化問題(KH Yeon et al., 2003)。
綜合以上技術評估整理如 表1,離子交換法較符合廠內技術選擇要求,可達到Co濃度達ppb等級,避免衍生二次污染物(相轉換),並且可資源化(符合未來廠內規劃電鍍鈷棒),因此將以離子交換法做為測試處理方法[3][6][7][8]。
|
處理技術 |
原理 |
應用案例 |
優點 |
缺點 |
|---|---|---|---|---|
|
離子交換樹酯法 |
利用離子價數只對重金屬具有選擇性 |
陽(陰)離子交換樹酯、螯合型離子交換樹酯 |
技術簡單 |
僅適用於低濃度重金屬 |
|
化學混凝沉澱法 |
溶解度積>Ksp |
OH-、CO32- |
適合高濃度重金屬 |
因Ksp限制會殘留一定量重金屬 |
|
吸附法 |
利用離子價數只對重金屬具有選擇性 |
活性碳、沸石、奈米碳管 |
適合中低農度之重金 屬成本低於樹酯 |
去除能力受限於所選擇之吸附基材 |
|
薄膜法 |
利用分子篩、半透膜去除重金屬 |
RO、電透析 |
適合微量之重金屬 |
耗能 |
|
電化學法 |
利用電場與極性吸附或形成電混凝去除金屬 |
電透析、EDR |
重金屬去除效率高 |
耗能 |
試驗與方法
經由文獻探討硫酸鈷廢水處理技術分析結果,離子交換法較符合2019廠區硫酸鈷廢水處理技術要求,因此本測試將探討: 廠區鈷廢水來源及處理系統效率要求、樹酯Na+ type與H+ type之選擇(由於Co濃度要求ppb,所以選擇強陽樹指為測試對象)、硫酸鈷廢水操作最適pH、無金屬鈷分析儀的情況,找出Co廢水處理前後水質酸鹼度/導電度及金屬鈷,線性物理性關係作為系統預警之參考指標、Co循環經濟與去化問題,硫酸鈷廢液還原鈷金屬回收再利用(還原法)。
結果與分析
2019年廠區鈷廢水來源及處理系統效率推估
2019年廠區鈷金屬廢水排放濃度要求需小於0.0023 mg/L (2.3ppb) (內控小於1.15 ppb),針對鈷廢水來源進行廠區各股水源Co濃度分析,並分析對納管放流貢獻比例,調查詳如 表2,來源包含、ECP(Co)74.5%、CMP(Co)25%、Parts Clean 0.3%與PVD製程產生Co洗滌廢水(0.2%),W-CoSO4 (大於3%委外處理),經由上述得知金屬鈷主要來源為ECP(Co)與CMP(Co), 表2分析中若依據鈷金屬廢水排放濃度要求未來廠內使用任何技術處理Co廢水效率需達>99%,經由處理後Co廢水所有流佈皆為濃度控制的重要關鍵,所以建議新廠要進行鈷廢水處理前,需進行廠內Co來源與濃度質量平衡,建立Co database,以利建立處理設施效率指標 圖1。
|
System |
每台水量CMD |
台數 |
濃度(ppm) |
系統處理效率 (%) |
處理後放流貢獻 (ppm) |
對納管放流貢獻比例 |
|---|---|---|---|---|---|---|
|
W-CoSO4 |
1.35 |
3 |
30,000 |
NA |
NA |
高濃度Co委外處理 |
|
ECP(Co) |
2 |
8 |
70 |
99.0% |
0.000700 |
74.5% |
|
Co CMP |
25 |
10 |
1.50 |
99.0% |
0.000234 |
25.0% |
|
Parts clean |
0.3 |
2 |
6.87 |
99.0% |
0.000003 |
0.3% |
|
PVD Co LSC |
0.48 |
46 |
0.16 |
99.0% |
0.000002 |
0.2% |
|
放流估算值 |
|
|
|
|
0.000939 |
|
|
目標 |
|
|
|
|
<0.00115 |
|
圖1、廠區內Co流佈來源調查與質量平衡示意圖
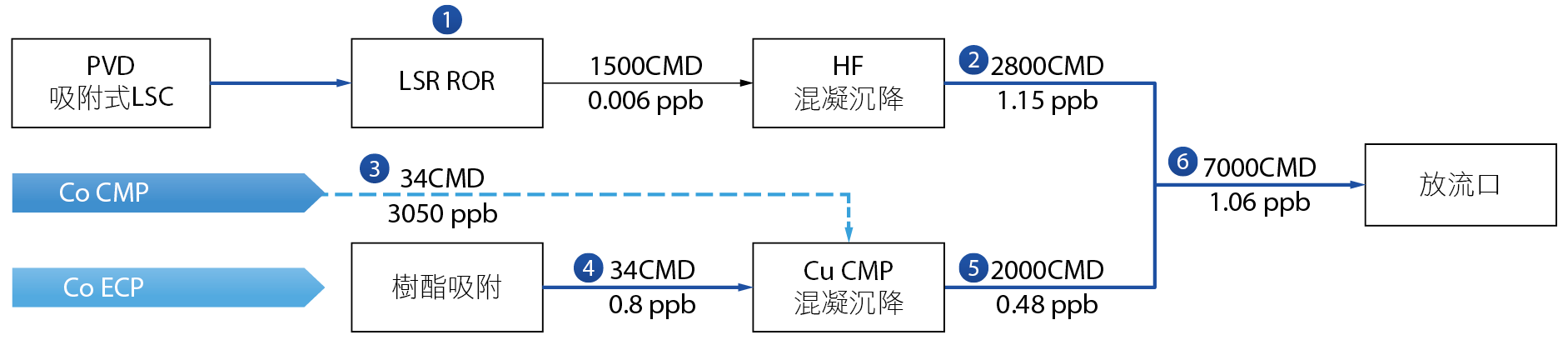
2019 年廠區鈷廢水質特性
2019年廠區鈷廢水水質調查詳如 表3,含Co金屬濃度為ECP(Co)40-97.5 mg/L、CMP(Co)等於1.14~2.0mg/L、Parts Clean等於6.87mg/L與PVD製程產生Co洗滌廢水等於0.16 mg/L,其中ECP(Co)與CMP(Co)酸鹼值(pH)分別為2~2.95與8~8.61,另外,ECP(Co),顆粒表面電位2.93mV,粒徑10-900nm、CMP(Co)顆粒表面電位 -15.44mV,粒徑30~70nm,廢水中並含有硼與H2O2及COD,依據上述水質得知,可以利用ECP (Co)與CMP(Co)pH不同進行兩股水pH調整,減少化學品添加藥量,CMP(Co)含有研磨顆粒會造成樹酯處理系統阻塞,需要有前處理過濾設施。
|
em |
ECP Co |
CMP Co |
|---|---|---|
|
pH' |
2.0-2.95 |
8-8.61 |
|
導電度(μS/cm) |
4910 |
43 |
|
總固體物(mg/L) |
1442 |
564 |
|
總溶解固體物(mg/L) |
1442 |
564 |
|
懸浮固體物(mg/L) |
N.D. |
N.D. |
|
雙氧水(mg/L) |
491 |
55 |
|
SiO2 (mg/L) |
366 |
54.2 |
|
鉀(mg/L) |
N.D. |
7.85 |
|
鈉(mg/L) |
N.D. |
<1 |
|
硼(mg/L) |
118 |
N.D. |
|
鈷(mg/L) |
40-97.5 |
1.14-2.0 |
|
化學需氧量(mg/L) |
260 |
112 |
|
介達電位(mV) |
2.93 |
-15.44 |
|
粒徑範圍(nm) |
10-900 |
30-70 |
硫酸鈷廢水吸附樹酯選擇與影響 (Na+ type與H+ type)
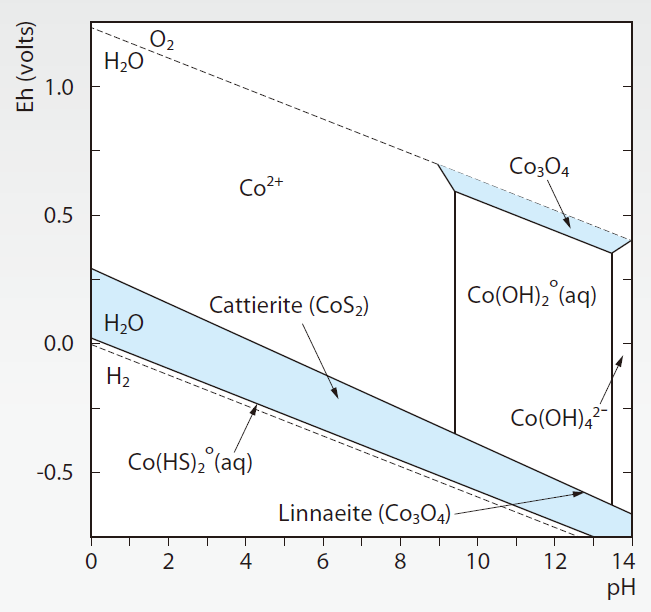
由於ECP(Co)偏酸性, CMP(Co)為鹼性,所以需要選擇適宜吸附樹酯避免吸附效果不佳造成放流超標風險,樹酯分為Na+ type與H+ type。選擇Na+ type樹酯吸附鈷金屬同步會交換出Na離子,隨著吸附時間增加,使得水體pH水質偏鹼,造成鈷金屬為非離子型態而無法有效被樹酯交換吸附,且隨著pH增加形成氫氧化鈷Co(OH),造成吸附樹酯阻塞,造成放流超標風險 圖2,因此建議選擇H+ type樹酯作為金屬鈷吸附與交換type,當H+ type進行鈷金屬吸附與交換時,同時交換出H+離子,使得水體逐漸偏酸,鈷金屬保持於離子態,容易被樹酯交換與吸附,但是要注意進流廢水pH不宜過低小於3.5,因為過於太酸會使得原本吸附與交換於樹酯表面Co再度被酸洗析出,所以建議進流鈷廢水pH控制於4.5~6.5之間最佳,pH調整可利用ECP Co偏酸與Co CMP偏鹼特性進行水質調整。
圖2、鈷金屬 pH v.s. pE圖 [1]
Co濃度分析監測方法與指標建立
由於廠內鈷金屬內控濃度為1.15 ppb,Co濃度監測分析以ICP-MS或ICP-AES為主要分析儀器系統昂貴,目前Co金屬濃度監控皆委託外部廠商分析,系統操作並無即時監測分析儀,系統風險高,有鑑於此,本測試依據學理「樹酯與金屬鈷置換物化特性,發展出金屬鈷濃度推估與樹酯吸附飽和預警機制」。
M1+ + Re·M2⇔M2+ + Re·M1 ......(1)
Co2+ + 4H+Ex→CoEx2 + 2H+ ......(2)
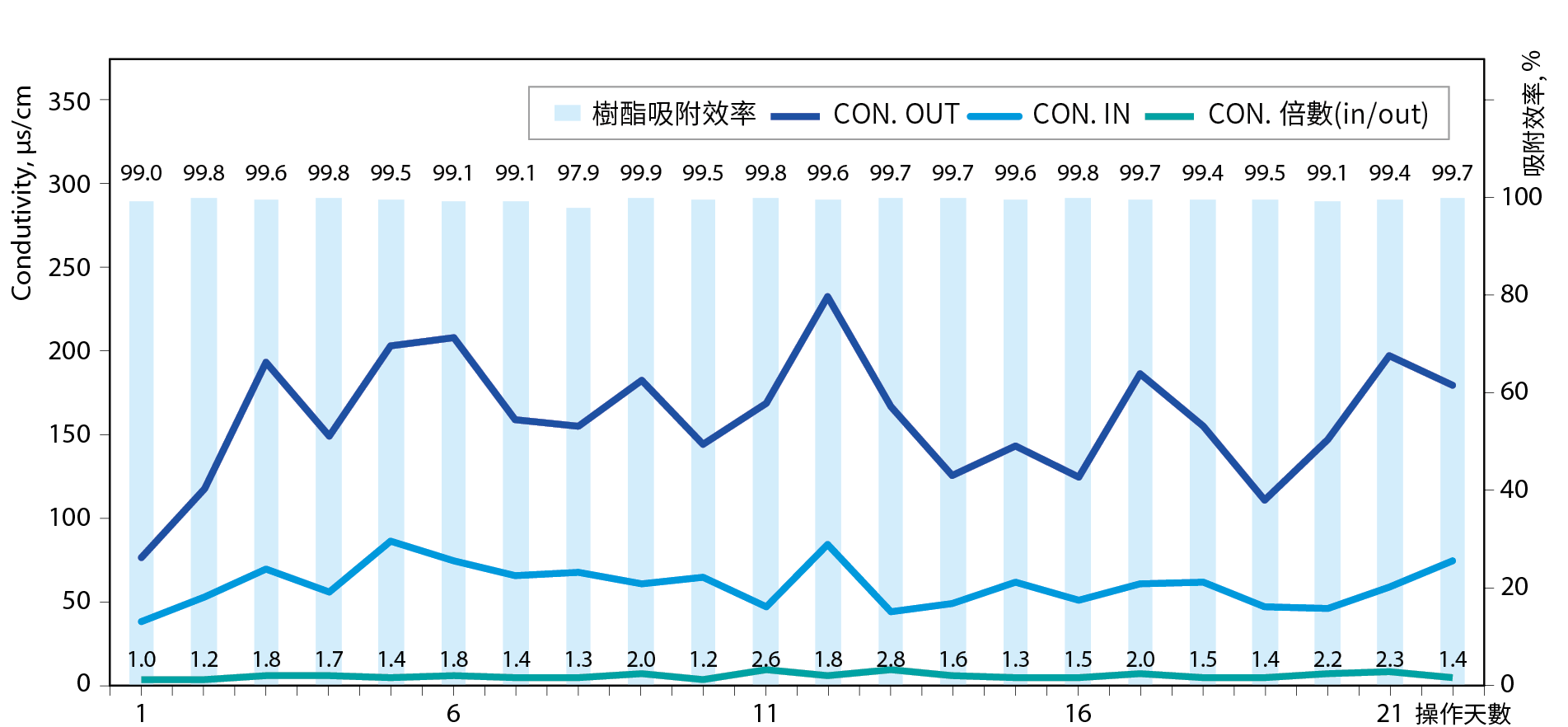
SAC強陽樹酯表面含有H+與鈷金屬(Co2+)交換後會釋出2個H+如方程式(2),所以水系統中pH會下降,導電度會增加約兩倍 圖3,依據此特性發展出監測pH與導電度變化即可得知樹酯吸附效率與Co金屬濃度變化,且水體維持pH酸性將有助於Co金屬保持離子態使SAC樹酯更有效吸附與交換。相反的若水體的導電度無法維持在1.2至2倍操作範圍且pH值逐漸往鹼性或上升即為SAC效能衰減之訊號即需要更換樹酯(水系統維持pH3以上,避免水體太酸,交換於樹酯表面Co金屬再度溶出)。也要注意水體有其他陽離子會競爭吸附,但是整體而言當導電度入出口差距小於1倍即需要更換樹酯,依此理論對照實際廢水操作現況如 圖4。 圖4中得知當SAC與廢水中陽離子交換時導電度約上升1.2至2倍,樹枝吸附校率約99.5以上,須注意於 2019年廠區鈷廢水來源及處理系統效率推估中提到,由於內控鈷濃度需小於1.15ppb所以樹酯吸附效率須達大於99%以上。
圖3、SAC強陽樹酯與Co金屬交換理論示意圖[1]
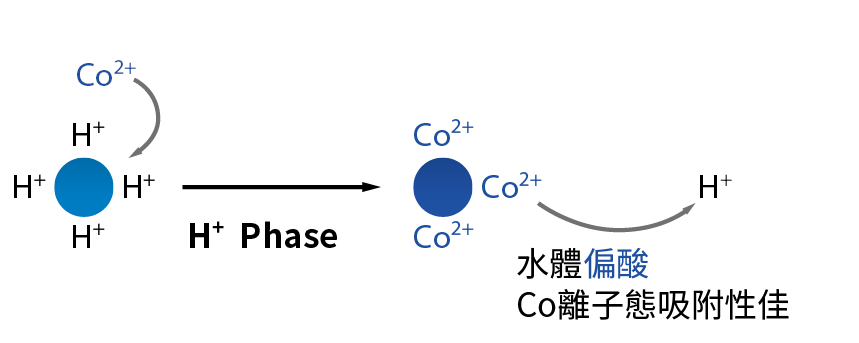
圖4、硫酸鈷廢水與SAC交換導電度與樹酯吸附效能變化
如上所述由於廠內Co來源除了硫酸鈷drain以外還有PVD tool所產生氣體洗滌下來廢水為基礎,所以經由計算硫酸鈷樹酯出口需小於20ppb以下,才能確保廠區Co濃度符合標準 圖5,所有Co濃度搭配導電度,Co濃度皆小於20ppb。由於硫酸鈷廢水含有雙水將會破會SAC樹酯結構,所以以活性碳去除雙氧水,並控制於H2O2小於10ppm以下,超標即更換ACF。
圖5、硫酸鈷廢水與SAC交換導電度與Co濃度變化
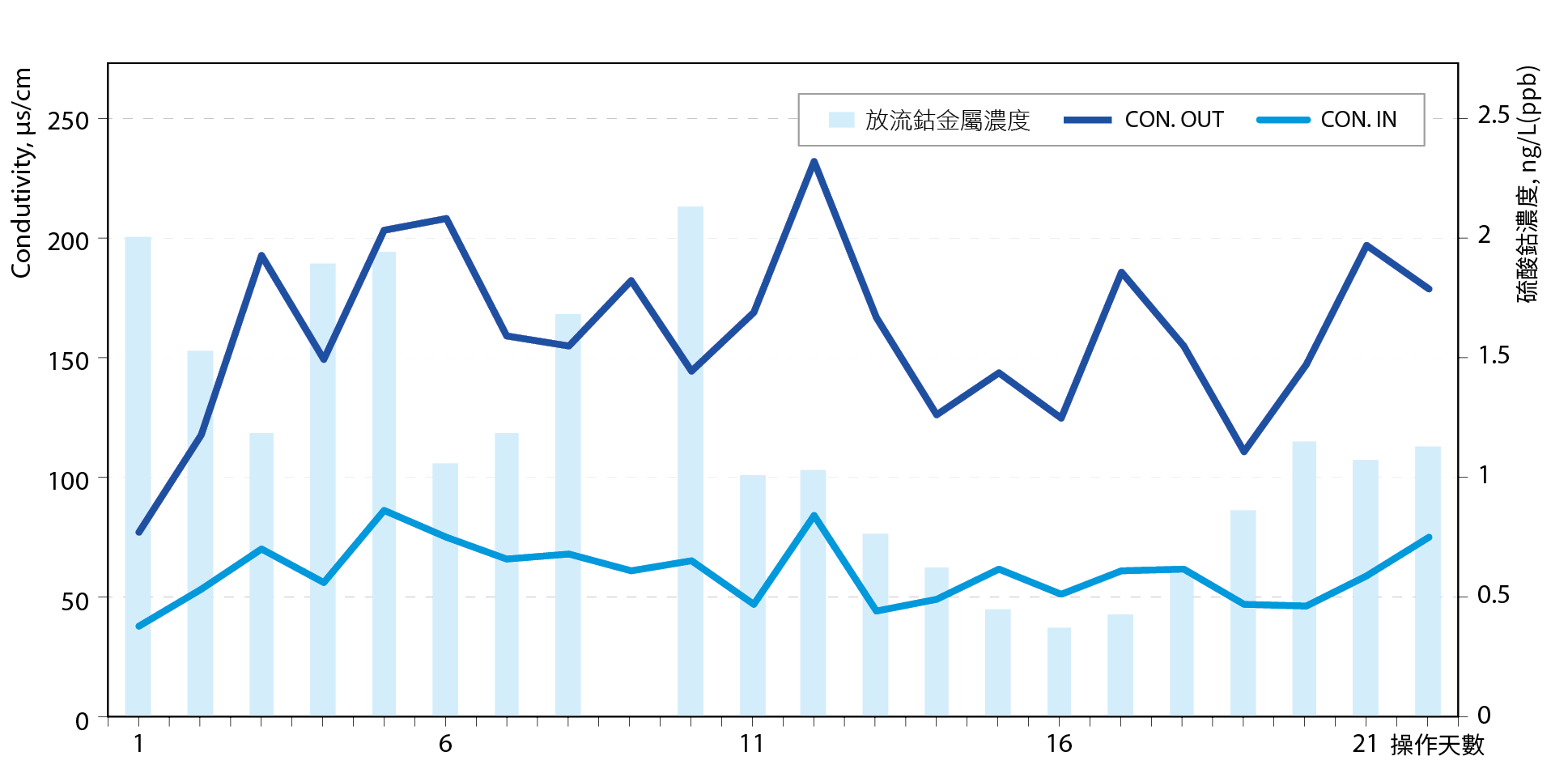
綜合以上結論,CMP(Co)加上ECP(Co)合流處理:pH4至6.5;活性碳出口濃度大於10mg/L,即更換或再生;SAC鎖住樹酯出口Co濃度大於20ppb即再生樹酯;SAC入出口導電度差值1.2至2 倍。
循環經濟─
有價金屬鈷回收之評估(還原法)
2019年廠區目前以電鍍方式將硫酸鈷轉換為有價金屬鈷棒,此篇文章測試還原法可做為回收鈷金屬方法參考,硼氫化納法與硫氫化鈉法。上述兩種方式皆以還原劑將金屬鈷還原後形成有價金屬可做回收,詳述如下。
硼氫化納法
將還原劑(NaBH4)加入硫酸鈷廢液將形成→鈷金屬顆粒↓(沉澱,具磁性),由於Co金屬為顆粒狀具有磁性可以磁鐵或過濾回收 圖6,硼氫化納法化學式如下方程式(1) [7][8]
CoSO4+2NaBH4+6H2O→
Co+2H3BO3+Na2SO4+7H2 ......(1)
圖6、硼氫化納還原具磁性鈷金屬

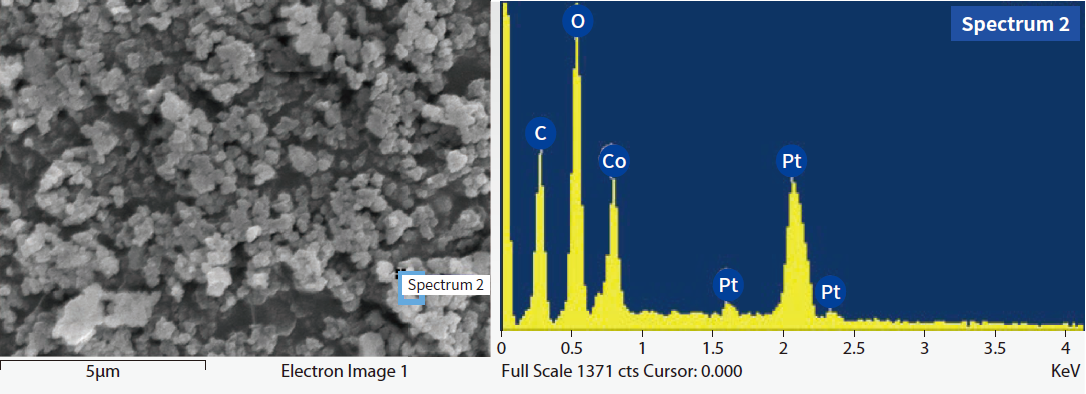
經由SEM/EDX分析皆確認形成Co金屬且具回收價值 圖7,經由計算回收1噸3%硫酸鈷汙泥,需用NaBH4(10%)水溶液146kg,可產生11.4kg鈷金屬污泥,詳見方程式(11)。
圖7、SEM/EDX分析鈷金屬成分
硼氫化納法加藥量推估 .......(2)
假設1噸汙泥含3%CoSO4→ 1000kg×3%=30kg(CoSO4) ......(3)
CoSO4分子量:155g/mol,
NaBH4分子量:37.83g/mol ......(4)
30kg CoSO4為30000/155=193.5mol ......(5)
CoSO4+2NaBH4+6H2O→
Co+2H3BO3+Na2SO4+7H2 ......(6)
由反應式可看出1mol CoSO4需
2mol NaBH4來反應 ......(7)
故193.5mol CoSO4需
193.5×2 =387mol NaBH4 ......(8)
轉換回質量:387×37.83=14643.87g= 14.64kg ......(9)
需純NaBH4 14.6kg,10%NaBH4水溶液
需146kg ......(10)
產物量:Co=11.4kg、H3BO3= 23.9kg、Na2SO4=27.5 kg、H2= 677.25g ......(11)
硫氫化納法
將還原劑(NaHS)加入硫酸鈷廢液將形成→鈷金屬顆粒沉澱,化學式如下方程式......(12) [8]
CoSO4+NaHS→
CoS+½Na2SO4+ ½H2SO4 ......(12)
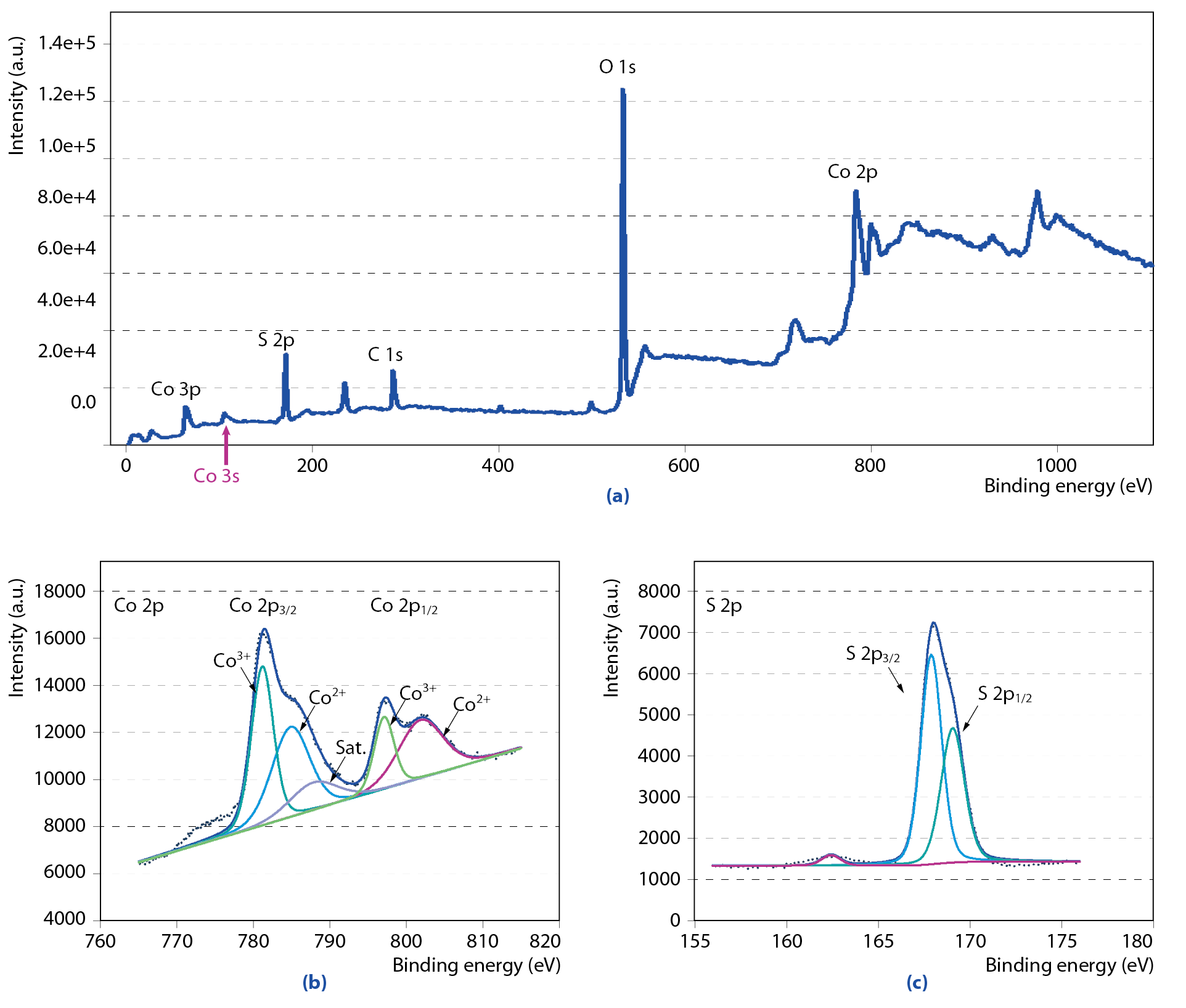
經由XPS分析皆確認形成Co全波段定性掃描於Binding energy 782 eV產生波峰,於185Ev產生硫(S)波峰 圖8(a)左,並且於2P 1/2軌域及3/2軌域皆由CoS金屬產生且具回收價值 圖8(b)(c),經由計算回收1頓3%硫酸鈷污泥,需用NaHS(35%)水溶液30.97kg,可產生17.6kg硫化鈷金屬污泥(算法略)。
圖8、XPS binding energy分析硫化鈷金屬成分
綜合以上兩種還原方法雖皆可有效作為金屬Co回收再利用,但是過量加藥將產生H與S氣體則需要小心處理與監控,避免產生危害。
結論
硫酸鈷廢水為先進半導體首次面對的挑戰,建議新廠要進行鈷廢水處理前需進行廠內Co來源與濃度質量平衡,建立Co database,以利建立處理設施效率指標,目前操作指標可參考為:CMP(Co)加上ECP(Co)合流處理原水調控pH範圍4至6.5;活性碳出口濃度大於10mg/L,即反洗或更換;SAC樹酯出口Co濃度大於20ppb即再生樹酯;SAC入出口導電度差值1.2至2倍維持高效樹酯交換效率,並可作為監控樹酯效率標準,若要進行其他鈷金屬回收方法可參考還原法,成反應高純度鈷金屬顆粒,並且可以電磁鐵或過濾法直接回收資源化。
參考文獻
- Werner Stumm, “Aquatic Chemistry: Chemical Equilibria and Rates in Natural Waters (3 rd)”.
- Qiu, Y Zheng, “Removal of lead, copper, nickel, cobalt, and zinc from water by a cancrinite-type zeolite synthesized from fly ash”, Chemical Engineering Journal, 2009.
- Ö Yavuz, Y Altunkaynak, F Güzel, “Removal of copper, nickel, cobalt and manganese from aqueous solution by kaolinite”, Water research, 2003.
- S Szöke, G Pátzay, L Weiser, “Cobalt (III) EDTA complex removal from aqueous alkaline borate solutions by nanofiltration, Desalination”, 2005.
- S Rengaraj, SH Moon, “Kinetics of adsorption of Co (II) removal from water and wastewater by ion exchange resins”, Water research, 2002.
- KH Yeon, JH Seong, S Rengaraj, “Electrochemical characterization of ion-exchange resin beds and removal of cobalt by electrodeionization for high purity water production”, Separation Science and Technology, 2003.
- Wen-Pin Hsieh, Jill Ruhsing Pan, Chih-Pin Huang, “Enhance the photocatalytic activity for the degradation of organic contaminants in water by incorporating TiO2 with zero-valent iron”, Science of The Total Environment, 2009.
- Yangang Li, Wen-Pin Hsieh, C.P. Chin-pao Huang, “Combined ultrasound and Fenton (US-Fenton) process for the treatment of ammunition wastewater”, Journal of hazardous materials, 2012.

留言(0)